Оценка активности коллагеназы in vitro с использованием модифицированного спектрофотометрического метода на основе желатина
Оценка активности коллагеназы in vitro с использованием модифицированного спектрофотометрического метода на основе желатина
Аннотация
Коллагеназа — ключевой фермент деградации коллагена, играющий важную роль в физиологических и патологических процессах. Существующие методы оценки ее активности часто отличаются высокой стоимостью, сложностью или недостаточной селективностью. В данной работе представлен разработанный экономичный и воспроизводимый спектрофотометрический метод определения коллагеназной активности, основанный на гидролизе желатина и колориметрическом детектировании продуктов реакции с Кумасси Бриллиантовым Синим G-250 (CBBG). Ключевым научным достижением и новизной представленной работы является разработка и внедрение этапа селективного осаждения после инкубации коллагеназы с желатином. Метод валидирован на коммерческой коллагеназе Clostridium histolyticum. Показаны высокая чувствительность (предел обнаружения менее 0,1 УЕ/мл), линейность в широком диапазоне концентраций фермента и времени инкубации, хорошая воспроизводимость (коэффициенты вариации < 8%) и специфичность (полное ингибирование ЭДТА, оптимум активности в нейтрально-щелочной области). Метод предлагает эффективную альтернативу дорогостоящим подходам для рутинного скрининга и контроля активности коллагеназ.
1. Введение
Коллагеназы (ММП-1, -8, -13, бактериальные) представляют семейство Zn²⁺-зависимых металлопротеиназ, специфически гидролизующих коллаген . Мониторинг их активности критически важен для фундаментальных и прикладных исследований в биохимии, медицине и биотехнологии .
Существующие методы имеют ограничения:
1. Нингидриновый метод: трудоемок, недостаточно специфичен, чувствителен к мешающим факторам , .
2. Метод с окрашенным коллагеном: требует специализированного субстрата, при этом введение красителя может влиять на свойства субстрата или активность фермента, потенциально искажая результаты .
3. Метод Мандла: крайне длителен, малопригоден для кинетических исследований , .
4. Методы с синтетическими субстратами: обеспечивают высокую чувствительность и скорость, но используют дорогостоящие пептиды, не всегда корректно отражающие гидролиз нативного коллагена , .
Цель данной работы — разработка простого, экономичного и селективного спектрофотометрического метода оценки коллагеназной активности на основе гидролиза желатина. Научная новизна заключается в разработке и внедрении этапа селективного осаждения после инкубации коллагеназы с желатином. Эта процедура эффективно решает проблему недостаточной селективности многих существующих методов, направленно удаляя негидролизованный субстрат и высокомолекулярные фрагменты (>10 кДа). В результате последующая колориметрическая детекция с использованием стандартного и доступного реагента Брэдфорда (CBBG)
специфично отражает количество образовавшихся низкомолекулярных пептидов — прямых продуктов коллагеназного гидролиза.2. Материалы и принципы исследования
2.1. Реактивы и оборудование
Использовали коммерческую коллагеназу типа I (Clostridium histolyticum), высокоочищенный желатин, Кумасси Бриллиантовый Синий G-250 (CBBG), бычий сывороточный альбумин (БСА), ЭДТА, 1,10-фенантролин, трипсин. Приготовление растворов: стандартный раствор БСА (1 мг/мл), буферные системы (Трис-HCl, 50 мМ, pH 7,5, с CaCl₂ и NaCl).
Оборудование: спектрофотометр с детекцией при 595 нм, охлаждаемая центрифуга, термостатируемый шейкер, pH-метр, дозаторы.
2.2. Протокол определения коллагеназной активности
Принцип метода: основан на колориметрическом определении (CBBG, 595 нм) низкомолекулярных пептидов, образующихся при гидролизе желатина коллагеназой. После инкубации фермента с субстратом проводится селективное осаждение негидролизованного желатина и высокомолекулярных фракций (>10 кДа) с помощью с помощью кислоты и охлаждения. Супернатант, содержащий целевые продукты гидролиза, подвергается колориметрии.
Процедура анализа (n ≥ 3):
1. Реакционная смесь: в пробирки вносят стандартный объем раствора желатина (оптимальная концентрация установлена) в буфере (50 мМ Tris-HCl, pH 7,5, с ионами Ca²⁺ и Na⁺), предварительно прогретый до 37°C.
2. Запуск реакции: добавляют раствор коллагеназы. Контроль — буфер.
3. Инкубация: строго контролируемое время при 37°C с перемешиванием.
4. Остановка и осаждение: добавляют охлажденный кислотный стоп-реагент. Тщательно перемешивают. Инкубируют на льду для завершения осаждения.
5. Центрифугирование: проводят при охлаждаемых условиях для осаждения нерастворимой фракции.
6. Отбор супернатанта: аккуратно переносят аликвоту прозрачного супернатанта.
7. Колориметрия: добавляют коммерческий реагент Брэдфорда (CBBG). Инкубируют. Измеряют ОП при 595 нм против контроля.
2.3. Построение калибровочной кривой и единицы активности
Строили калибровочную кривую по разведениям БСА (0-100 мкг/мл). Активность выражали в Условных Единицах (УЕ): 1 УЕ соответствовала активности, высвобождающей эквивалент 1 мкг БСА низкомолекулярных пептидов за время инкубации в стандартных условиях.
2.4. Валидационные испытания
Линейность по ферменту и времени: измеряли активность при варьировании концентрации фермента и времени инкубации.
Воспроизводимость: оценивали внутрисерийную и межсерийную вариабельность.
Предел обнаружения (LoD): рассчитывали на основе стандартного отклонения сигнала холостой пробы и наклона калибровочной кривой.
Влияние pH: измеряли активность в Трис буфере pH 4,0–10,0.
Специфичность/Ингибирование: испытывали ингибиторы металлопротеиназ (ЭДТА, 1,10-фенантролин) и влияние предварительного гидролиза субстрата трипсином.
Кинетика Михаэлиса-Ментен: определяли начальные скорости при разных концентрациях желатина.
3. Основные результаты
3.1. Валидация и оптимизация метода
Калибровочная кривая по БСА показала высокую линейность (R² > 0,99) в диапазоне 0–100 мкг БСА/мл.
Установлены оптимальные концентрации субстрата и компонентов буфера.
Установлена линейная зависимость активности коллагеназы (мкг БСА-экв.) от её концентрации в диапазоне 0,1–5,0 УЕ/мл с коэффициентом детерминации R² > 0,99. Линейный характер зависимости также подтвержден для времени инкубации до 90 минут (рис. 1).
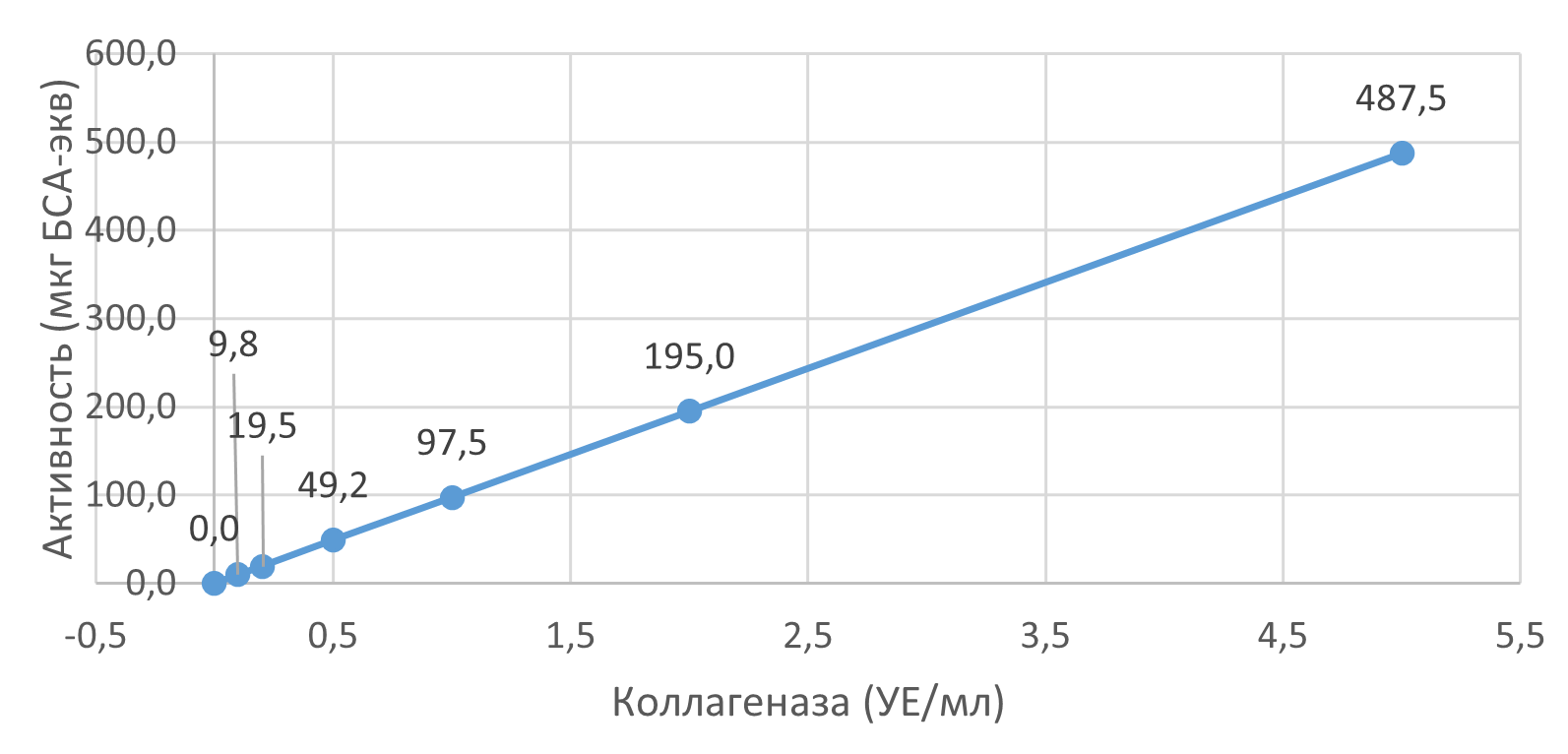
Рисунок 1 - Зависимость активности от концентрации коллагеназы
Предел обнаружения (LoD) составил менее 0,1 УЕ/мл.
Таблица 1 - Воспроизводимость внутрисерийная и межсерийная
Концентрация (УЕ/мл) | Внутрисерийная (n=6) | Межсерийная (n=3) | ||
Среднее ± SD | CV% | Среднее ± SD | CV% | |
0,5 | 48,3 ± 1,9 | 3,9 | 47,5 ± 3,2 | 6,7 |
1,0 | 97,1 ± 3,7 | 3,8 | 95,8 ± 6,5 | 6,8 |
2,0 | 194,2 ± 7,8 | 4,0 | 190,5 ± 14,2 | 7,5 |
3.2. Влияние pH на активность
Коллагеназа проявляла выраженный оптимум активности в нейтрально-щелочной области (pH 7,0–8,0). Активность снижалась на >80% при pH < 6,0 и > 9,0 (рис. 2).
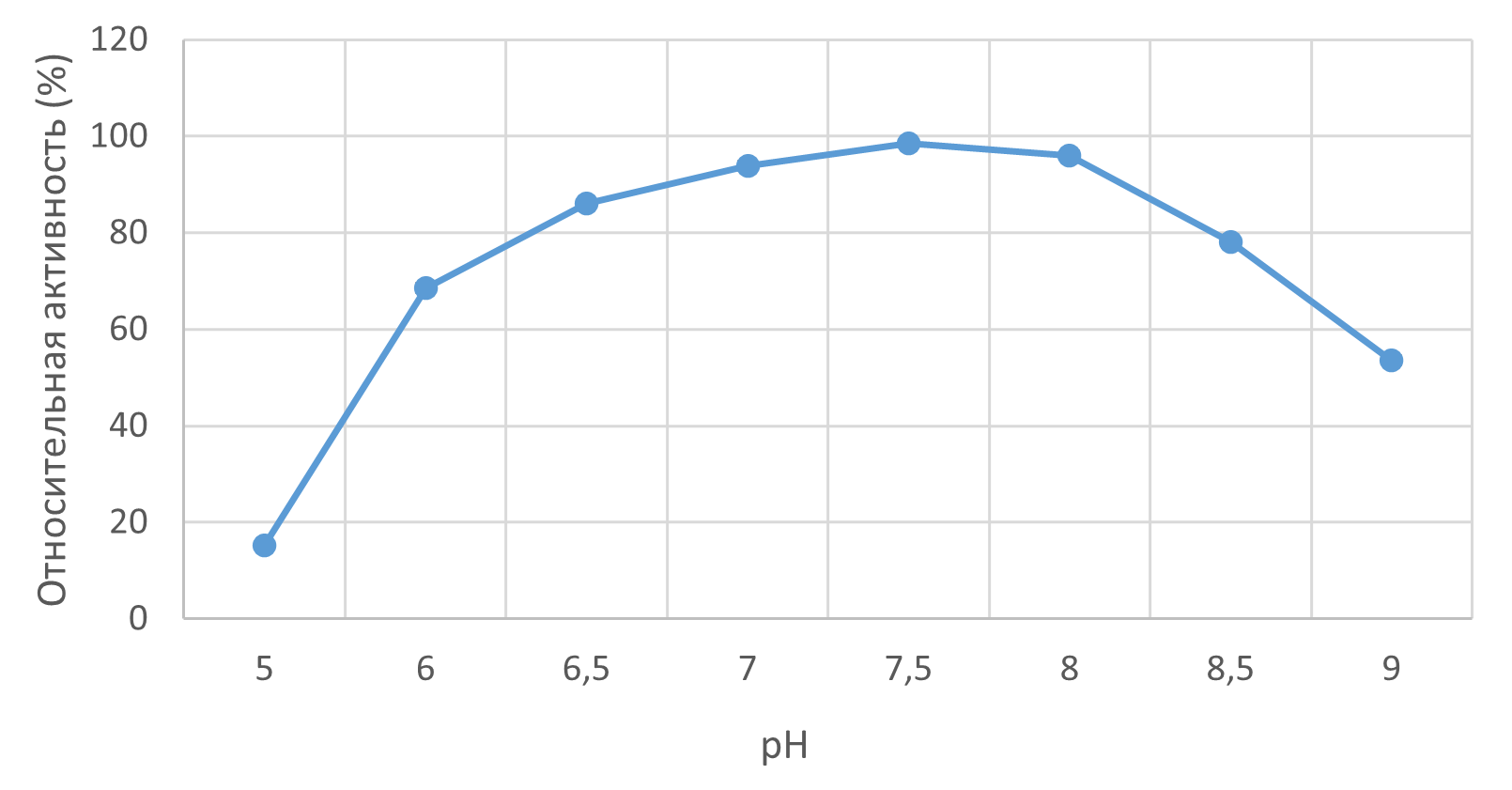
Рисунок 2 - Профиль зависимости рН
Активность полностью подавлялась ЭДТА (5 мМ) и значительно ингибировалась 1,10-фенантролином (1 мМ), подтверждая Zn²⁺-зависимость (рис. 3).
Предварительная обработка желатина трипсином не влияла на последующую детекцию продуктов коллагеназного гидролиза (p > 0,05).
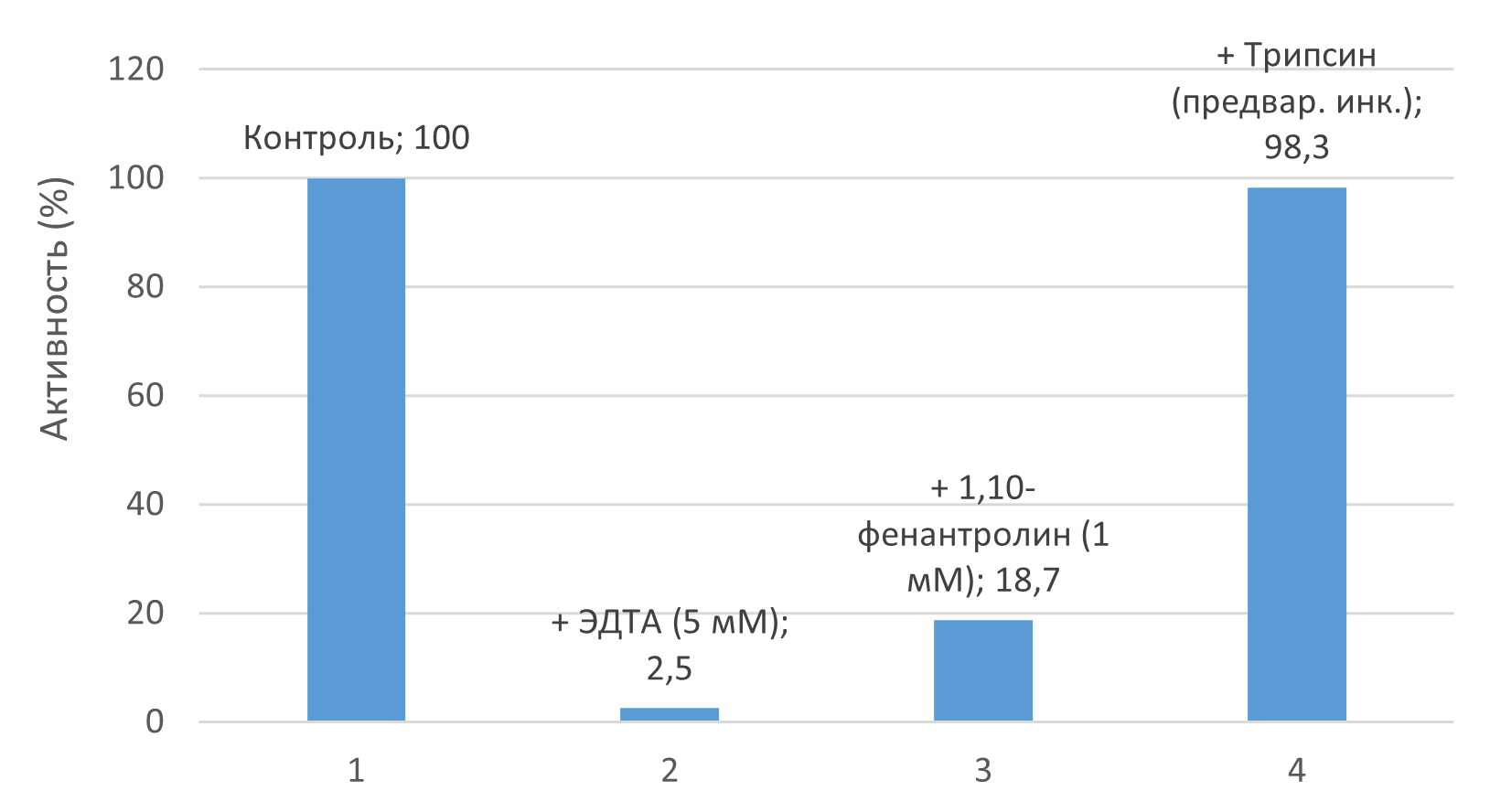
Рисунок 3 - Специфичность метода
· Определены параметры кинетики Михаэлиса-Ментен для гидролиза желатина. Значения Kₘ и Vₘₐₓ соответствовали литературным данным для данного типа фермента и субстрата (рис. 4).
· Высокое значение константы специфичности подтвердило высокую каталитическую эффективность исследуемой коллагеназы в гидролизе желатина в рамках разработанного метода.
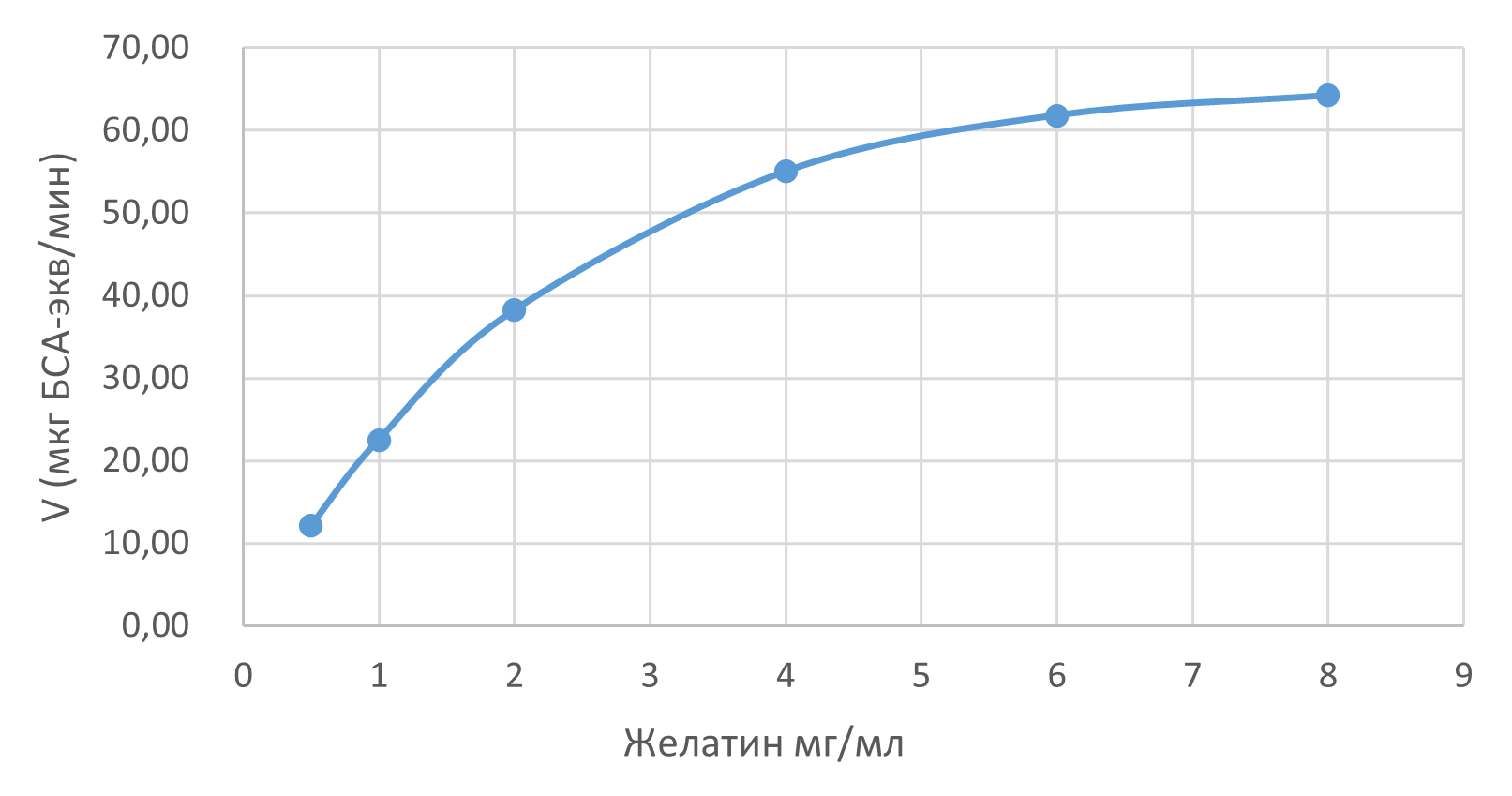
Рисунок 4 - Кинетика фермента
4. Обсуждение
Разработанный метод сочетает простоту, экономичность и высокую аналитическую эффективность.
Основные преимущества:
1. Селективность: оптимизированная процедура осаждения является ключевым элементом, обеспечивающим детекцию преимущественно низкомолекулярных продуктов гидролиза, специфичных для действия коллагеназы на желатин. Это принципиальное отличие от методов, детектирующих общую растворимую фракцию .
2. Экономичность: использование доступного желатина и стандартного реагента Брэдфорда существенно снижает стоимость анализа по сравнению с методами на синтетических субстратах.
3. Простота и скорость: протокол не требует сложных манипуляций и может быть выполнен в стандартной лаборатории.
4. Валидированность: метод продемонстрировал отличные аналитические характеристики (чувствительность, линейность, воспроизводимость), соответствующие требованиям количественного анализа. Полученный LoD сопоставим или лучше многих альтернативных спектрофотометрических подходов , , .
5. Специфичность: полное ингибирование хелаторами металлов и корректный pH-профиль подтверждают регистрацию именно металлопротеиназной (коллагеназной) активности.
Сравнительная оценка (табл. 2): метод выгодно отличается от аналогов по совокупности критериев: стоимости, селективности к низкомолекулярным продуктам, времени анализа и применимости для рутинного использования.
Таблица 2 - Сравнительная характеристика методов определения коллагеназной активности
Параметр | Разработанный метод | Нингидриновый | Метод Мандла | Синтетические субстраты |
Время анализа | 120 мин | >180 мин | 24-48 ч | 30 мин |
Стоимость | Низкая | Средняя | Низкая | Очень высокая |
LoD (УЕ/мл) | 0,1 | 1,0 | – | 0,05 |
Селективность | Высокая | Низкая | Умеренная | Высокая |
Ограничения: как и в других методах, использующих белковые субстраты, сигнал может регистрировать вклад неспецифических протеаз в сложных образцах. Для таких случаев рекомендована предварительная очистка или использование специфических ингибиторов.
Области применения:
– Контроля активности препаратов коллагеназы.
– Скрининга ингибиторов/активаторов металлопротеиназ.
– Кинетических исследований фермента.
– Стандартизации методик в биотехнологии.
5. Заключение
Разработан и валидирован новый спектрофотометрический метод оценки активности коллагеназы на основе гидролиза желатина. Основное научное достижение — внедрение оптимизированной процедуры селективного осаждения после ферментативной реакции, обеспечивающей высокую специфичность детекции низкомолекулярных продуктов гидролиза с помощью красителя CBBG.
Метод характеризуется:
– Простотой исполнения и доступностью реагентов.
– Высокой чувствительностью (LoD < 0,1 УЕ/мл) и воспроизводимостью (CV < 8%).
– Адекватной специфичностью к коллагеназной активности.
– Линейностью по концентрации фермента и времени.
Полученные кинетические параметры соответствуют природе фермента и субстрата. Преимущества метода перед аналогами — сочетание экономичности, селективности к целевым продуктам гидролиза и пригодности для рутинного использования — делают его ценным инструментом для научных и прикладных задач в области биохимии и биотехнологии.
