Сравнительный анализ нуклеотидной и аминокислотной последовательности белка химозина в эволюционном ряду млекопитающих
Сравнительный анализ нуклеотидной и аминокислотной последовательности белка химозина в эволюционном ряду млекопитающих
Аннотация
В статье представлены результаты по сравнительному анализу аминокислотной и нуклеотидной последовательности экзонов химозина в области каталитического центра (в положении 25-220) млекопитающих различных сред обитания, с различным рационом питания используя инструменты филогенетического анализа. Получены данные по выравниванию нуклеотидной и аминокислотной последовательности экзонов химозина, определены консервативные и вариабельные участки, проведен попарный сравнительный анализ нуклеотидной и аминокислотной идентичности, определен спектр встречаемости аминокислот по белку в целом и в области каталитического центра. В ходе филогенетического анализа по дендрограмме, построенной для нуклеотидной последовательности гена химозина, выделены клады шести групп, которые сформировали представители анализируемых семейств. Полученные данные, могут использоваться для прогнозирования пищеварительных и иммунных функций белка на клеточном уровне.
1. Введение
Химозин (Chn, EC 3.4.23.4), неонатальная желудочная аспарагиновая пепсиноподобная протеаза молодых млекопитающих, вызывает свертывание молока посредством расщепления пептидных связей κ-казеина (κCS) на участке Met105-Phe106 и применяется для производства сыров , , , . Фактически, использование Chn при производстве сыра считается одним из самых ранних биологических применений ферментов, а остатки сыра датируются примерно 3000-2800 годами до н.э. , , , . Chn синтезируется как пре-прохимозин, который расщепляется до зрелого белка Chn за счет отщепления 16-ти аминокислот, который образуют гидрофобный сигнальный пептид , .
Клеточные сигнальные аспарагиновые протеазы (APS) повсеместно распространены в природе и выполняют разнообразные функции от пищеварения до участия в формировании иммунитета , , , . APS разделены на различные семейства на основе гомологии, структуры и чувствительности к пепстатину , . APS включают в себя пять надсемейств и 16 семейств. Большинство принадлежат к семейству A1 – пепсиноподобных APS. Структурно пепсиноподобные AP обычно определяются двумя гомологичными доменами, которые охватывают два каталитических остатка аспарагиновой кислоты в триплете Asp-Thr/Sergly , , , .
Хотя роль Chn в свертывании молока и производстве сыра хорошо известна, в то же время анализ эволюционной динамики в ряду позвоночных аминокислотной и нуклеотидной последовательности крайне актуальна, в связи с тем, что Chn был обнаружен у большого числа видов, как наземных, так и водных млекопитающих , . Анализ аминокислотных последовательностей и кодирующих последовательностей белков (экзонов) занимает центральное место в изучении молекулярной эволюции. Среди основных инструментов — построение филогенетических деревьев, которые собираются на основе алгоритмов, учитывающих количество несовпадающих аминокислот или оснований между выровненными последовательностями.
Обоснования исследования белков заключаются в наличии механизмов мутаций и последующего отбора, которые приводят к изменению в кодирующей последовательности гена и, соответственно, в аминокислотной последовательности белка в процессе эволюции , , , . Так, в частности, дупликация и делеция генов являются мощными драйверами эволюционных изменений, которые иллюстрируются изменчивым ферментативным спектром, участвующим в переваривании белков позвоночных, включая Chn, и являются реакцией на общие факторы окружающей среды (среда обитания, терморегуляция, рацион питания) .
Потеря генов долгое время считалась второстепенной движущей силой адаптивной эволюции. Тем не менее, в настоящее время потеря генов рассматривается в качестве ключевого фактора в формировании эволюционных изменений , . Генетический репертуар генов желудка в ряду позвоночных, является хорошим примером ведущей роли потери генов в адаптивной фенотипической изменчивости , , . Анализ последовательности гена и первичной структуры аспарагиновых протеиназ птиц и млекопитающих (куриный эмбриональный пепсиноген, ренин и пепсиноген человека, химозин быка) выявил сходство в организации генов, и эти результаты подтверждают мнение о том, что эти гены ферментов произошли от общего предкового гена. Напротив, в аспарагиновых протеиназах S. cerevisiae, C. tropicalis, M. pusillus и M. Miekhey, в первичной структуре интрон не обнаружен. Однако в генах аспарагиновой протеиназы Rhizopus niveus и аспарагиноврй протеиназы A. awamori были обнаружены 1 и 3 коротких интронах соответственно, но их экзон-интронные соединения находились в других положениях, нежели в генах аспарагиновых протеиназ млекопитающих и птиц . Семейство генов пепсина широко распространено, но распределено хаотично в ряду млекопитающих, подвержено псевдогенизации, и как указывалось выше, потери гена , . Несмотря на псевдогенный статус у человека, Chn обнаружен у нескольких видов млекопитающих, рептилий и птиц, костистых рыб , , у приматов, кожнокрылых, грызунов, китообразных и непарнокопытных . Chn является псевдогеном у человека за счет сдвига рамки считывания и последующего преждевременного стоп-кодона, вызванного делецией в экзоне 4 .
В отличие от других членов семейства пепсинов, мало что известно об эволюционной истории, распространении и функции Chn в линиях млекопитающих, несмотря на то, что Chn демонстрирует консервативную четвертичную структуру и каталитические остатки, он проявляет необычный профиль с низкой общей протеолитической активностью и высокой специфичностью к κ-казеину молока , , , . Так, в частности, филогенетический анализ на основе ДНК и аминокислотных последовательностях гена Chn девятнадцати видов млекопитающих, рыб, птиц, рептилий и грызунов, выявил идентичность в диапазоне от 64% до 98% , . Аминокислотный сравнительный анализ рекомбинантного химозина (rChn) марала, быка и верблюда выявил, что последовательности зрелых химозинов оказались идентичными на 92,6%. rChn быка и верблюда имеют схожие третичные структуры, при этом идентичность их первичных структур составляет всего 84,8%. rChn быка и марала содержит больше отрицательно заряженных аминокислот . Построена модель пространственной структуры rChn лося с позиции топографии положительных и отрицательных поверхностных зарядов в сравнении с rChn коровы и верблюда. Ранее исследователи получили и изучили rChn овцы (Ovis aries), козы (Capra hircus), буйвола (Bubalus arnee bubalis) и верблюда (Camelus dromedarius) , , , . Позднее были получены и изучены rChn яка (Bos grunniens), альпаки (Vicugna pacos) и алтайского марала (Cervus elaphus sibiricus) , , .
Повторяющаяся инактивация Chn раскрывает эволюционные взаимодействия между пищеварительной и иммунной системами, регулируемого псевдогенизацией . Роль Chn в передаче IgG изучалась исключительно у жвачных животных, Chn расщепляет κCS и запускает высвобождение сывороточного белка, который содержит IgG, в кишечный тракт для неселективного всасывания в течение первых часов после рождения , , , .
Картина псевдогенизации гена Chn, по-видимому, совпадает с приобретением новых стратегий передачи иммунитета, как ранее предполагалось для плотоядных животных, приматов и грызунов, за исключением жвачных животных , , , . Хотя активность Chn напрямую связана со свертываемостью молока, она коррелирует с переносом иммуноглобулинов, зависящим от молозива и наличия ингибиторов трипсина в молозиве, что обеспечивает дополнительную защиту от ферментативного переваривания в тонком кишечнике , , . В связи с этим было высказано предположение, что такое видоспецифичное распределение является результатом диетической адаптации, результатом приобретения пассивного переноса материнского иммунного иммуноглобулина G (IgG) – «иммунная гипотеза». Однако стратегии передачи IgG у разных млекопитающих различаются, так в частности у человека, например, IgG передается от матери к плоду на последних стадиях беременности (материнский перенос).
В связи с этим цель нашего исследования – выявить отличительную особенность аминокислотной и нуклеотидной последовательности Chn млекопитающих различных сред обитания, с различным рационом питания используя инструменты филогенетического анализа, для получения данных, которые могут использоваться для прогнозирования функции белка на клеточном уровне.
2. Методы и принципы исследования
Нуклеотидная последовательность экзонов гена Chn была получена из базы данных NCBI в разделе Gene: Camelus bactrianus ferus (XP_006194819.1), Bos Bosgrunniens (JX839990.1), Bos Taurus (NP851337.1), Bubalus bubalis (XP006065015.1), Ovis aries (NP001009804.1), Capra hircus (NP001272688.1), Camelus dromedaries (NP_001290503.1), Rattus norvegicus (NP_064476.1), Cervus canadensis (MT225406.1), Delphinapterus leucas (XM_022583844.1), Tupaia chinensis (XM_006149562.1), Vicugna pacos (XM_031680278.1), Alces alces alces (MT542132.1), Capreolus pygargus (WGN96205.1). Множественное выравнивание (Multiple Sequence Alignment) нуклеотидных последовательностей проводилось с помощью базы данных EMBL-EBI (Великобритания) во вкладке CLUSTAL OMEGA.
Аминокислотная последовательность экзонов была получена из базы данных UniProt . Выравнивание аминокислотной последовательности производилась с использованием базы данных EMBL-EBI: Множественное выравнивание проводили во вкладке Multiple Sequence Alignment в разделе CLUSTAL OMEGA (Великобритания), парное – во вкладке Pairwise Sequence Alignment в разделе EMBOSS Needle.
Множественное выравнивание гомологичных последовательностей консервативных участков экзонов в области каталитического центра (в положении 25-220) было получено с помощью редактора выравнивания биологических последовательностей BioEdit. Редактирование и улучшение визуализации проводилось во вкладке Graphic View . Полученные данные визуализированы с помощью Excel с цветовым указанием семейств и сравниваемыми представителями семейств.
Филогенетический анализ проводили с использованием программы UniPro UGENE. Для построения филогенетического дерева использована модель Phylip Naighbor-Joining (Phylip Naighbor-Goining model), методом максимального правдоподобия на основе модели Tamura-Nei models , , , принимая во внимание различия в скорости замены между нуклеотидами и неравенство частот нуклеотидов, а также методом Neighbor-Joining method (NJ) для создания филогенетических (эволюционных) и фенетических (сходство на основе признаков) деревьев, на основе матрицы расстояний как метод минимальной эволюции .
Моделирование и визуализация трехмерной структуры. 3D модель химозина Camelus dromedaries построена в программе rcsb.org/3d-view/1CMS.
Статистическая обработка данных и визуализация полученных результатов проводилась с использованием пакетов программного обеспечения Prism 8.0.1 (Graphpad, USA) и Microsoft Excel.
3. Основные результаты и обсуждение
Анализируемые группы животных относятся к классу плацентарных млекопитающих водной и наземной среды обитания (рис. 1). Выбор для исследования представителей семейств определяется тем, что ген Chn данных представителей широко используется в качестве источника рекомбинантного химозина (rChn), ген интегрируется в состав экспрессионных челночных плазмид с дальнейшим включением в геном клеток продуцентов (E.сoli, Pichia pastoris, также известная как Komagataella phaffi, Kluyveromyces Lactis, Aspergillus niger и др.) для синтеза белка Chn , , , .
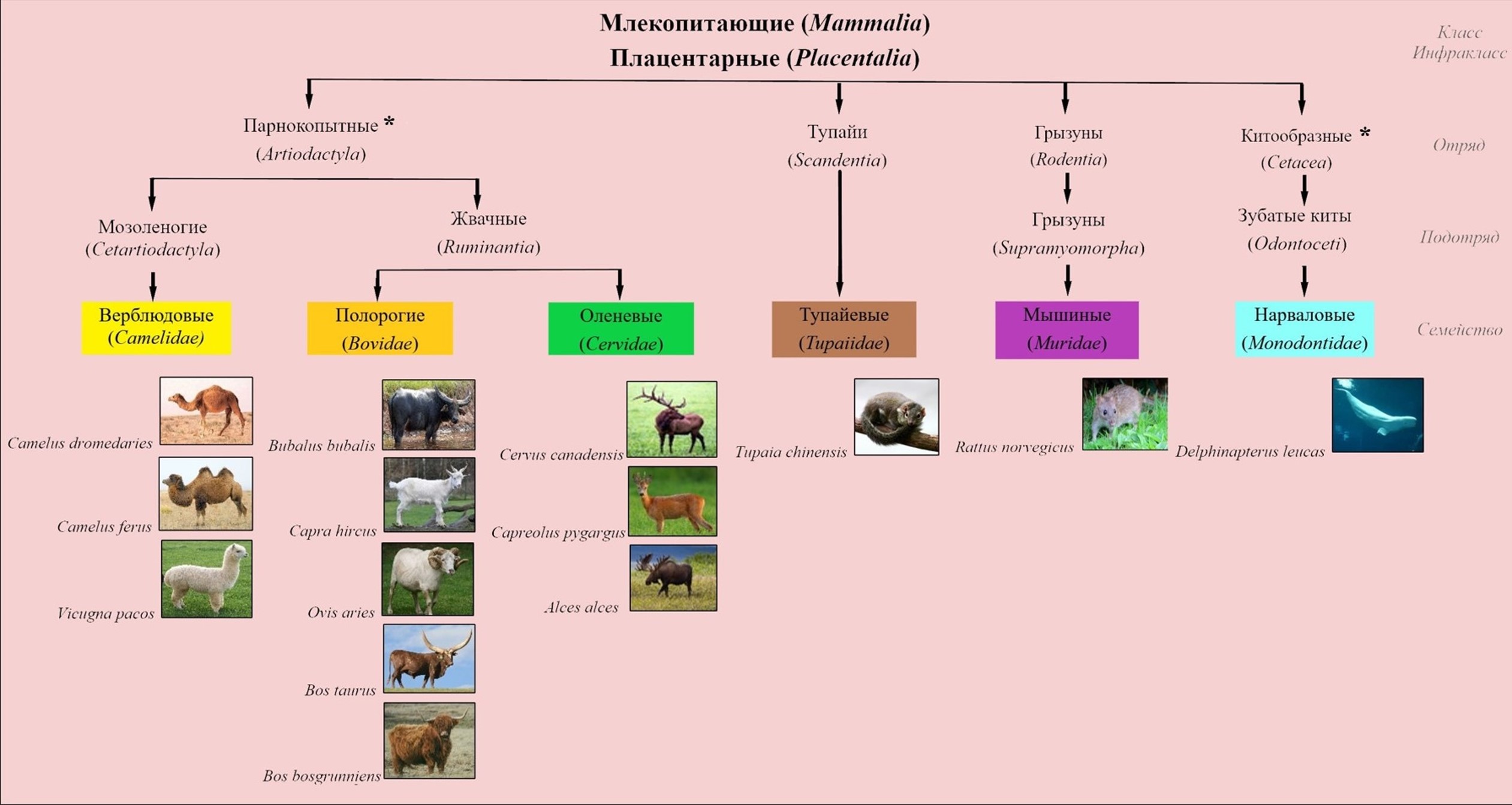
Рисунок 1 - Анализируемые представители семейств класса млекопитающие (Mammalia)
Примечание: * - отряды парнокопытные (Artiodactyla) и китообразные (Cetacea) объединяются в парафилетический отряд китопарнокопытные (Cetartiodactyla)
Наиболее консервативными остатками аминокислот и их позиции, после выравнивания по всем представителям семейств, являются – Lys-Gly-K (26-28), Leu-Arg (30-31), Leu-Lys-Glu (34-36), Gly-Leu-Leu-Glu-Asp-Phe-Leu (38-44), Gln (47), Ser (52), Gly (59), Pro-Leu-Thr (65-67), Tyr-Leu-Asp (69-71), Tyr-Phe-Gly (74-76), Ile-Tyr (78-79), Gly-Thr-Pro (81-83), Gln-Glu-Phe (85-87), Val (89), Phe-Asp-Thr-Gly-Ser-Ser (91-96), Trp-Val-Pro-Ser (99-102), Tyr-Cys (104-105), Ser (107), Val-Cys (109-110), H (113), Arg-Phe-Asp-Pro (115-118), Ser (121), Thr-Phe (123-124), Lys-Pro-Leu (129-131), Tyr-Gly-Thr-Gly-Ser (135-139), Leu (142), Tyr-Asp-Thr-Val-Thr-Val-Ser (146-152), Ile-Val (154-155), Gln-Thr-Val-Gly-Leu-Ser-Thr (159-165), Pro-Gly (168-169), Phe-Thr-Tyr (172-173), Phe-Asp-Gly- Ile-Leu- ly (177-182), Ala-Tyr-Pro (184-186), Ala (188), Tyr-Ser (192-193), Pro (195), Phe-Asp (197-198), Met-Met (200-201), Leu-Val-Ala (205-207), Asp (209), Phe- Ser-Val-Tyr (211-214), Arg (217) и Gln (220). Наибольшее количество замен одной аминокислоты среди анализируемых представителей выявлено у Rattus norvegicus (21 аминокислота, 12%). У Delphinapterus leucas (4 аминокислоты, 2,3%), Tupaia chinensis (3 аминокислоты, 1,7%), Alces alces (1 аминокислота, 0,6%).
Общий процент представленности аминокислот белка Chn (рис. 5, 6) выявил, что в наименьшем количестве представлены аминокислоты His и Trp, самая большая представленность Ser, Leu, Val и Glu. В области каталитического центра также в меньшем числе встречаются His и Trp, но дополнительно снижается количество Asn. Каталитический центр обогащен аминокислотами – Gly, Leu, Ser, Phe, Thr. Особо необходимо отметить, что фенилаланин (Phe) в большей мере представлен именно в области каталитического центра, в сравнении с его встречаемости в общей протяженности белка. Следовательно, в общей аминокислотной последовательности Chn и в области каталитического центра в меньшей мере присутствуют положительно заряженные и ароматические аминокислоты, а в области каталитического центра снижается количество полярных незаряженных аминокислот. Также по всей протяженности белка отмечается большое количество полярных незаряженных, алифатических и отрицательно заряженных аминокислот. Тогда как в области каталитического центра, спектр аминокислот расширяется наряду, с алифатическими, полярными незаряженными, отмечаются нейтральные и ароматические (которыми обогащен каталитический центр).

Рисунок 2 - Выравнивание кодирующей нуклеотидной последовательности гена химозина исследуемых семейств позвоночных животных:
1 - R. norvegicus; 2 - T. chinensis; 3 - V. pacos; 4 - C. ferus; 5 - C. dromedarius; 6 - D. leucas; 7 - C. canadensis; 8 - A. alces; 9 - C. pygargus; 10 - B. bubalis; 11 - B. grunniens; 12 - B. taurus; 13 - O. aries; 14 - C. hircus
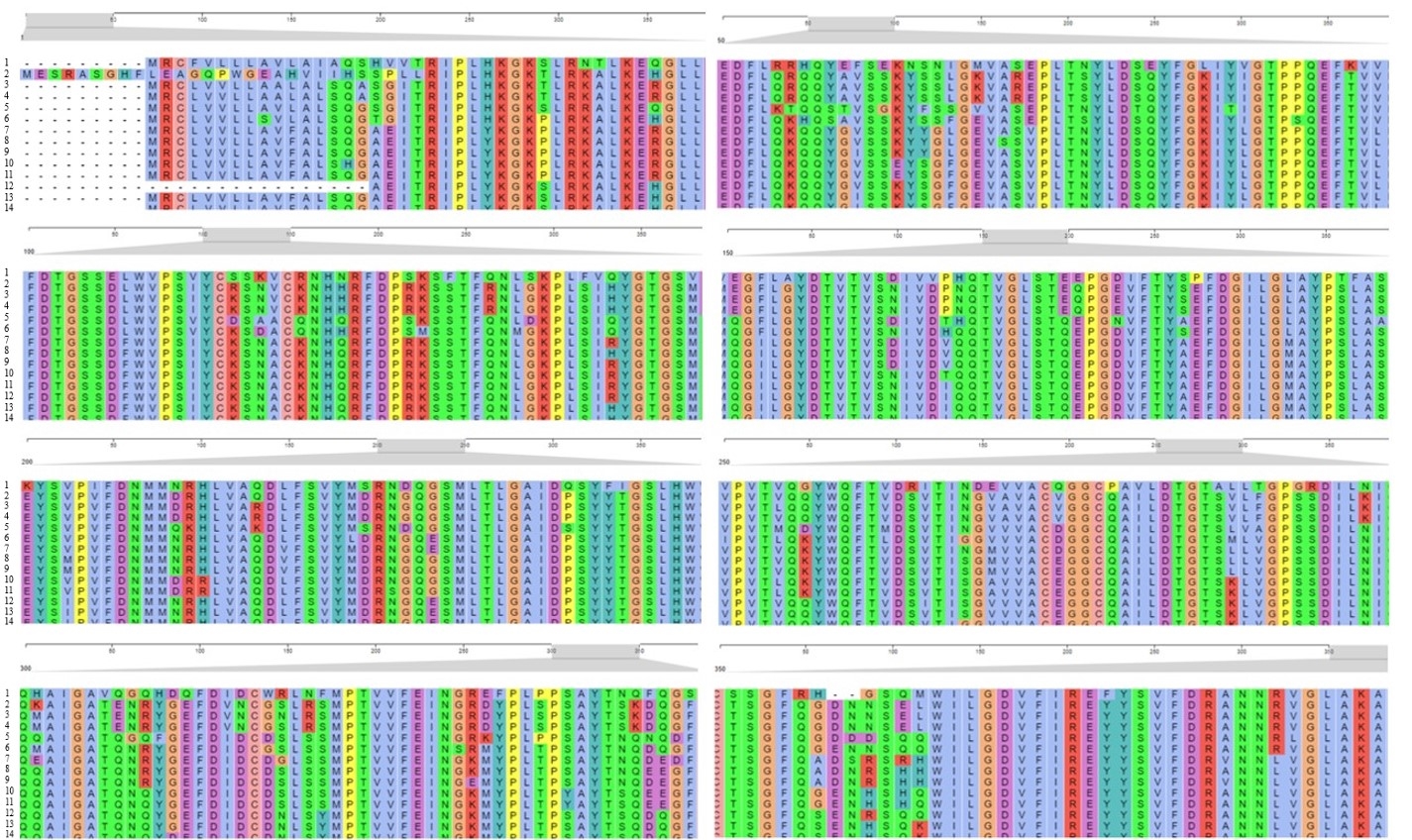
Рисунок 3 - Выравнивание аминокислотной последовательности гена химозина исследуемых семейств позвоночных животных:
1 - R. norvegicus; 2 - V. pacos; 3 - C. dromedarius; 4 - C. ferus; 5 - T. chinensis; 6 - D. leucas; 7 - C. canadensis; 8 - A. alces; 9 - C. pygargus; 10 - C. hircus; 11 - O. aries; 12 - B. bubalis; 13 - B. taurus; 14 - B. grunniens

Рисунок 4 - Консервативные участки (или отдельные аминокислоты) каталитического (активного центра) гена химозина исследуемых семейств позвоночных животных (выделены зеленым):
1 - C. dromedarius; 2- C. hircus; 3 - O. aries; 4 - B. taurus; 5 - R. norvegicus; 6 - C. ferus; 7 - B. grunniens; 8 - C. canadensis; 9 - D. leucas; 10 - T. chinensis; 11 - A. alces; 12 - C. pygargus; 13 - B. bubalis; 14 - V. pacos
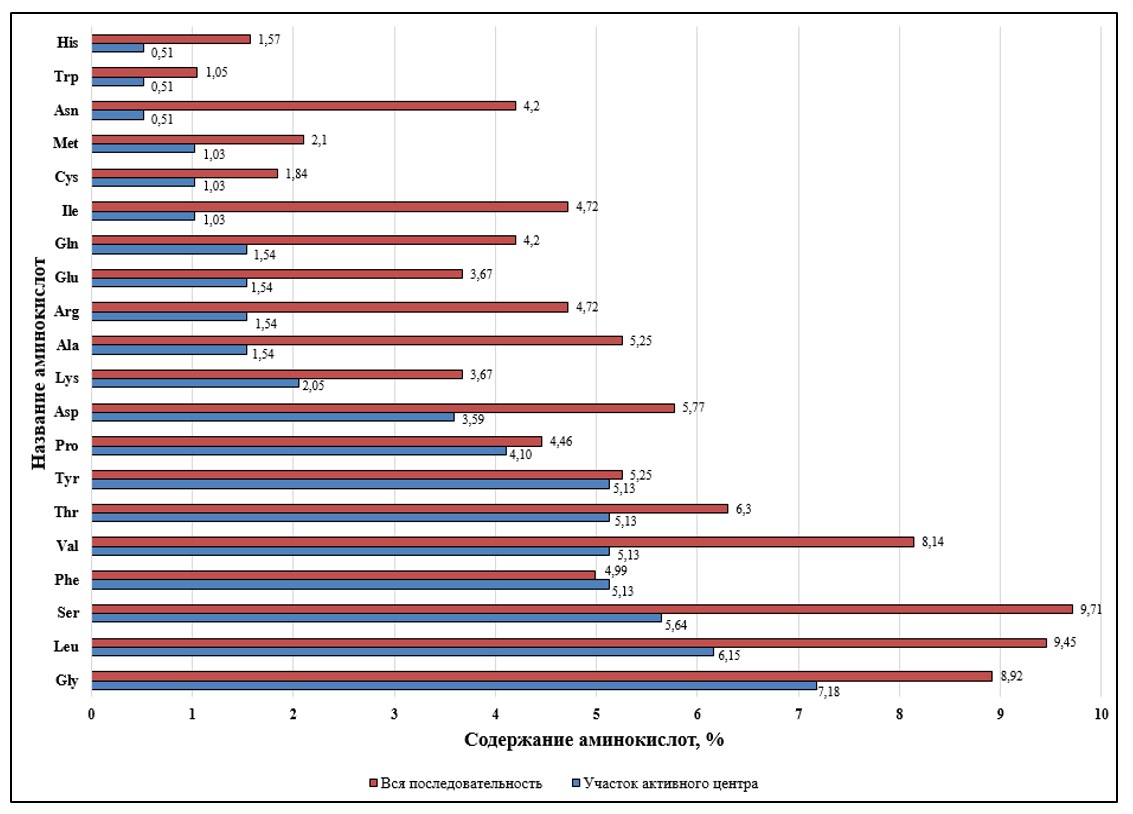
Рисунок 5 - Анализ содержания аминокислот в каталитическом центре и во всей аминокислотной последовательности химозина анализируемых семейств животных
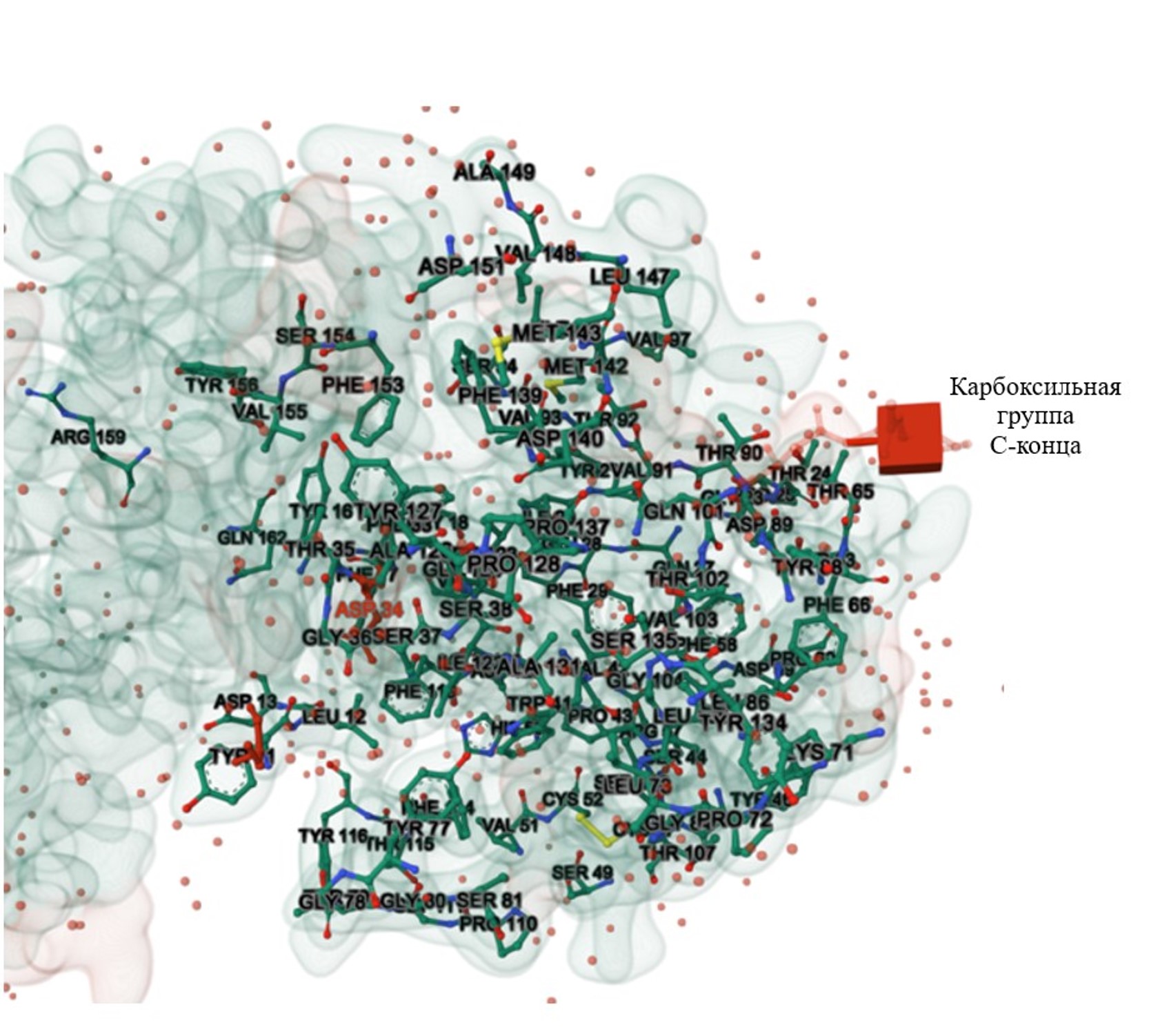
Рисунок 6 - 3D-модель каталитического центра белка химозина Camelus dromedaries с обозначением консервативныхучастков (синий и зеленые цвета)
- первая группа от 95-93% идентичности – отмечается между семействами Cervidae и Bovidae;
- вторая группа в диапазоне идентичности от 88-90% – отмечена у представителя семейства Delphinapterus leucas с Camelidae (C.ferus и C.dromedaries), Cervidae и Bovidae. А также у представителя семейства Camelidae с B.bubalis и B.Bosgrunniens (семейство Bovidae);
- третья группа в диапазоне идентичности от 85-87% – у представителей семейства Camelidae (C.ferus и C.dromedaries), с Cervidae и Bovidae. А также у V.pacos (семейство Camelidae) с B.Bosgrunniens (семейство Bovidae) и D.leucas;
- четвертая группа диапазон идентичности от 79-85% отмечен у T.chinensis (семейство Tupaiidae) с Camelidae, Cervidae, Bovidae и Delphinapterus leucas. А также V.pacos (семейство Camelidae) с Cervidae, Bovidae;
- пятая группа – идентичность представителя семейства Muridae (семейства R.norvegicus) в сравнении с другими семействами самая низкая – 74%.
Сравнительный попарный анализ аминокислотной идентичности (рис. 7) выявил различия с нуклеотидной. Так, в частности, нижний предел идентичности аминокислотной последовательности каталитического центра составляет 71-75%, верхний – 92-94%. Группы диапазона идентичности также отличаются:
- первая группа – 92-94%, полностью соответствует выявленной в первой группе нуклеотидной идентичности;
- вторая группа – диапазон идентичности составляет 85-87%. Также, как и в случае с нуклеотидной идентичностью, отмечено соответствие у представителя семейства Delphinapterus leucas с Camelidae, Cervidae и Bovidae. Отличием является то, что у представителей семейства Camelidae (C.ferus и C.dromedaries), аминокислотная идентичность выявлена не с B.bubalis и B.Bosgrunniens (семейство Bovidae), а с T.chinensis (семейство Tupaiidae) и Delphinapterus leucas;
- третья группа диапазон идентичности составляет 83-84%. Все представители семейства Camelidae (также, как и нуклеотидная идентичность) проявляют идентичность с Cervidae и Bovidae. А также отличительной особенностью является идентичность между T.chinensis (семейство Tupaiidae) и Delphinapterus leucas;
- четвертая группа диапазон идентичности от 81-82% отличием от выявленной нуклеотидной идентичности является лишь то, что у V.pacos (семейство Camelidae) идентичность выявлена с Delphinapterus leucas;
- пятая группа – идентичность 77-80% отмечена у V.pacos (семейство Camelidae) с Cervidae и Bovidae (кроме B.bubalis) и с T.chinensis (семейство Tupaiidae);
- шестая группа идентичность составляет 71-75% и полностью соответствует пятой группе по нуклеотидной идентичности гена Chn.
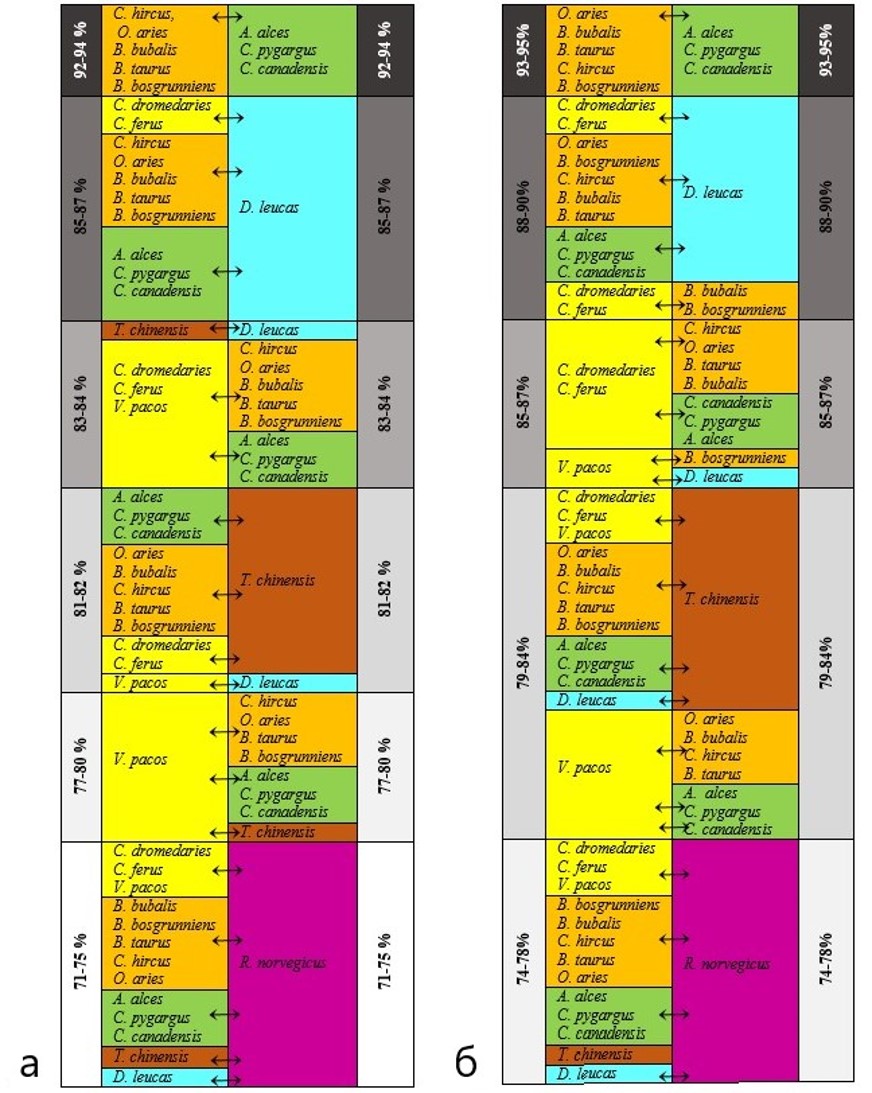
Рисунок 7 - Попарное сравнение аминокислотной (а) и нуклеотидной (б) идентичности каталитического участка химозина у представителей анализируемых семейств
Достаточно редко встречаются такие аминокислоты, как Trp (1,1-1,3%), Cys (1,5-1,9%), His (1,1-2,6%) и Met (1,8-2,9%). Самая редко встречающаяся ароматическая аминокислота – Trp, процентное содержание находится в пределах 1,1–1,3% и не проявляет выраженных отличий распределения у представителей анализируемых семейств. Серосодержащая аминокислота Cys также является редко встречающейся, содержание которой колеблется в пределах 1,8–1,9%, за исключением одного из представителей Camelidae (V. pacos – 1,5%) и Bovidae (B. bubalis – 1,6%). Положительно заряженные аминокислоты His в равной степени редко встречаются у представителей семейства Bovidae (1,1 – 1,6%), Camelidae (1,1 – 1,6%), Tupaiidae (1,3%) и большинства представителей Camelidae (1,6%, кроме V. pacos – 2,6%). У семейств Muridae и Delphinapterus leucas (R. norvegicus – 2,6% и D. leucas – 2,1%). Серосодержащая аминокислота Met отмечена у представителей семейства Cervidae (2,6 - 2,89%), Camelidae (V. pacos – 1,8%) и Muridae (R. norvegicus – 2,1%).
Относительно представленности других аминокислот среди представителей анализируемых семейств можно отметить, что положительно зараженная аминокислота Arg меньше всего отмечается у всех представителей Bovidae (2,4 – 3,2%), Tupaiidae (T. chinensis – 2,6%) и Delphinapterus leucas (D. leucas – 2,9%) и более всего у всех представителей Camelidae (4,4 – 4,7%) и Muridae (R. norvegicus – 4,5). Полярная незаряженная аминокислота Glu менее всего представлена у Tupaiidae (2,6%). Положительно зараженной аминокислоты Lys меньше всего у Tupaiidae (3,2%), Muridae (2,6%) и Delphinapterus leucas (2,9%). Такие аминокислоты алифатические как Asn, Pro, Ala, Ile и ароматическая Tyr не имеют ярко выраженных различий среди представителей анализируемых семейств. Тогда как ароматическая аминокислота Phe больше всего в каталитическом центре Chn у Muridae (7,1%), нейтральная аминокислота Gln – у Bovidae (6,3 – 7,1%) и Tupaiidae (7,1%), отрицательно заряженная аминокислота Asp и полярная незаряженная Thr – у Tupaiidae (7,4 – 7,6%).
Общий показатель консервативности по аминокислотному составу каталитического участка в положении 25 - 220 составляет 67% (118 идентичности из 175).
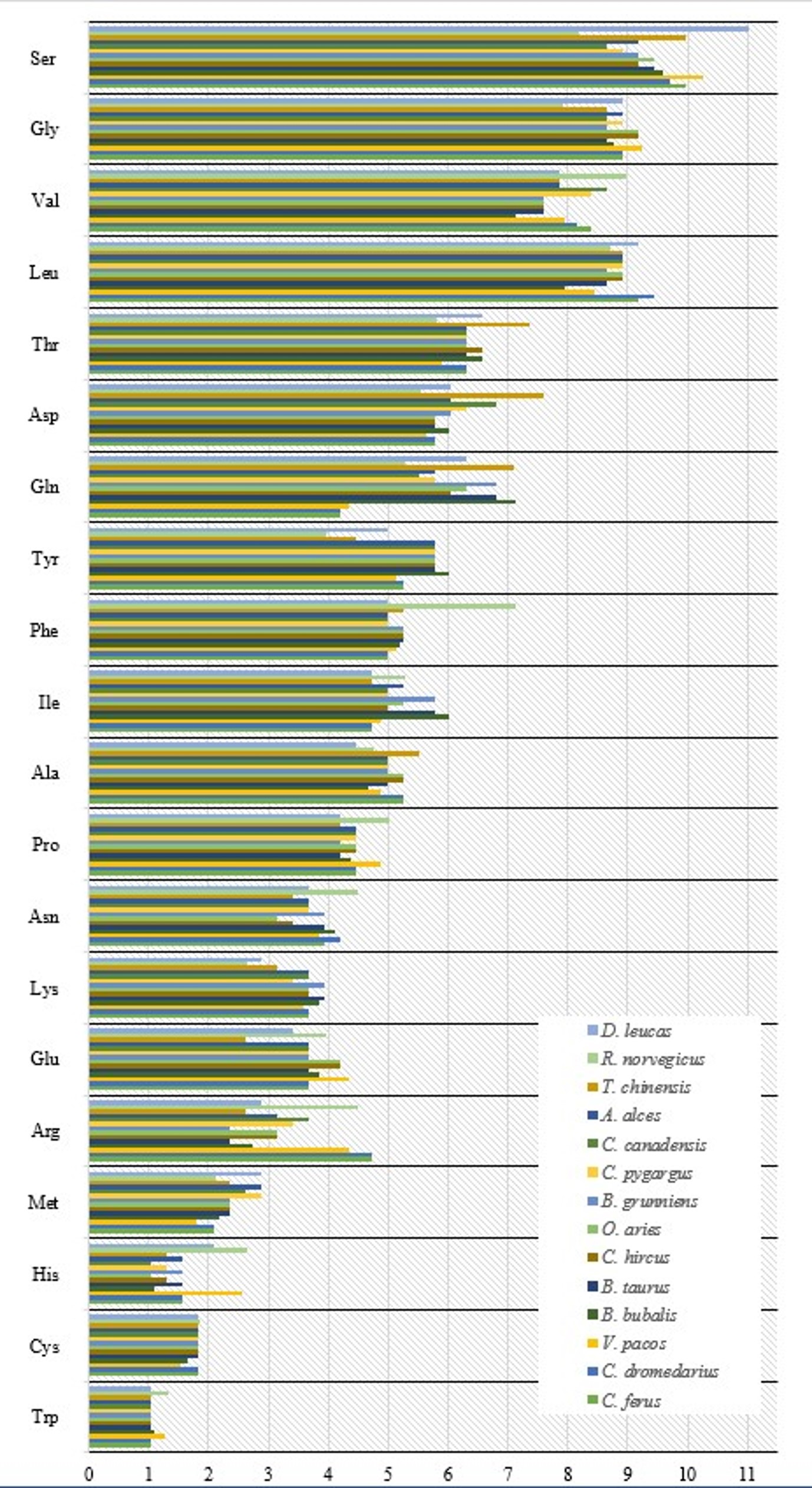
Рисунок 8 - Встречаемость аминокислот в области каталитического центра представителей анализируемых семейств
- группа I состоит из трёх видов семейства Camelidae (C. Dromedaries, Camelus ferus, Vicugna pacos);
- группа II включает три вида семейства Cervidae (A. Alce, C. Canadensis, C. pygargus);
- группа III – входят 5 видов семейства Bovidae, образующие две подгруппы.
В целом топология дерева трех групп соответствует топологии деревьев, построенных для других участков генома видов отряда Cetartiodactyla.
Отдельно стоят группы:
- группа IV – семейство Delphinapterus leucas;
- группа V – Muridae (семейства R.norvegicus)
- группа VI – T.chinensis (семейство Tupaiidae).
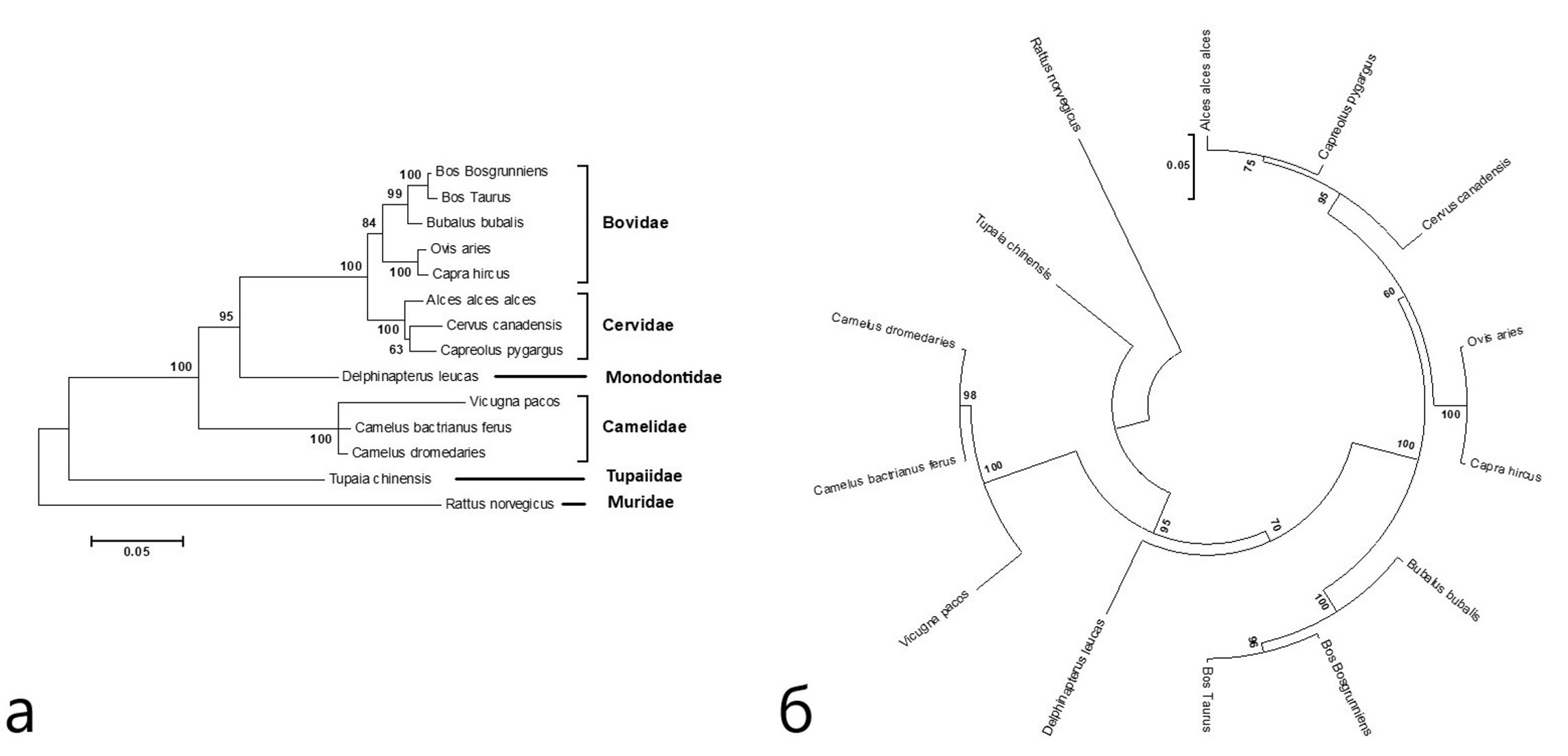
Рисунок 9 - Дендрограмма представителей анализируемых семейств построенная методом максимального правдоподобия на основе модели Tamura-Nei model (а) и метода присоединения соседей (Neighbor-Joining method) (б)
4. Заключение
Исследования Chn были сосредоточены главным образом на характеристике биохимических, структурных и функциональных свойств для промышленных целей , , , , в то же время анализ эволюционной динамики в ряду позвоночных аминокислотной и нуклеотидной последовательности крайне актуальна , , в связи с тем, что Chn был обнаружен у большого числа видов, как наземных, так и водных млекопитающих . Обоснованием для исследования белков заключается в механизмах мутаций, которые определяют изменения нуклеотидной последовательности гена и последовательно приводят к изменениям последовательности аминокислот в белке в процессе эволюции , , , . Так, в частности, дупликация и делеция генов, потеря генов и псевдогенизация , , , являются мощными драйверами эволюционных изменений, которые иллюстрируются изменчивым ферментативным спектром, участвующим в переваривании белков позвоночных включая Chn и являются реакцией на общие факторы окружающей среды, терморегуляции организма, рацион питания , соответственно рассматриваются в качестве ключевого фактора в формировании эволюционных изменений , , что определяется необходимостью в адаптивной фенотипической изменчивости с морфофункциональными последствиями для организмов , , . Более того, APS выполняют разнообразные функции от пищеварения до участия в формировании иммунитета , , , . Анализ генов Chn у разных млекопитающих выявил сходство в организации генов и эти результаты подтверждают мнение о том, что эти гены ферментов произошли от общего предкового гена .
Несмотря на то, что Chn демонстрирует высокую консервативность структуры и аминокислотных остатков в области каталитического центра , , , в ходе наших исследований выявлено, что наиболее консервативными остатками аминокислот и их позиции в области каталитического центра являются – Lys-Gly-K (26-28), Leu-Arg (30-31), Leu-Lys-Glu (34-36), Gly-Leu-Leu-Glu-Asp-Phe-Leu (38-44), Gln (47), Ser (52), Gly (59), Pro-Leu-Thr (65-67), Tyr-Leu-Asp (69-71), Tyr-Phe-Gly (74-76), Ile-Tyr (78-79), Gly-Thr-Pro (81-83), Gln-Glu-Phe (85-87), Val (89), Phe-Asp-Thr-Gly-Ser-Ser (91-96), Trp-Val-Pro-Ser (99-102), Tyr-Cys (104-105), Ser (107), Val-Cys (109-110), H (113), Arg-Phe-Asp-Pro (115-118), Ser (121), Thr-Phe (123-124), Lys-Pro-Leu (129-131), Tyr-Gly-Thr-Gly-Ser (135-139), Leu (142), Tyr-Asp-Thr-Val-Thr-Val-Ser (146-152), Ile-Val (154-155), Gln-Thr-Val-Gly-Leu-Ser-Thr (159-165), Pro-Gly (168-169), Phe-Thr-Tyr (172-173), Phe-Asp-Gly- Ile-Leu- ly (177-182), Ala-Tyr-Pro (184-186), Ala (188), Tyr-Ser (192-193), Pro (195), Phe-Asp (197-198), Met-Met (200-201), Leu-Val-Ala (205-207), Asp (209), Phe- Ser-Val-Tyr (211-214), Arg (217) и Gln (220). В белке в целом меньше всего встречаемость His и Trp, самая большая представленность Ser, Leu, Val и Glu. В области же каталитического центра, также, как и в общем в белке, в меньшей мере встречаются His и Trp, но дополнительно снижается количество Asn. Каталитический центр обогащен аминокислотами – Gly, Leu, Ser, Phe, Thr. Особо необходимо отметить, что фенилаланин (Phe) в большей мере представлен именно в области каталитического центра, в сравнении с его встречаемостью в общей протяженности белка.
Сравнительный анализ, после выравнивания, нуклеотидной и аминокислотной последовательности в области каталитического центра Chn у представителей анализируемых семейств выявил, что самая высокая идентичность отмечается в обоих случаях между семействами Cervidae, Bovidae и Camelidae (C. Dromedaries, Camelus ferus). Наименьшая, у семейства Muridae (семейства R.norvegicus) со всеми анализируемыми представителями семейств.
Выявлены специфические идентичности по нуклеотидной последовательности, которые формируются у Vicugna pacos (семейство Camelidae) с Bovidae, Delphinapterus leucas и Cervidae. Тогда как самая высокая идентичность по аминокислотной последовательности в области каталитического центра отмечена у Camelidae (C. Dromedaries, Camelus ferus) с T.chinensis (семейство Tupaiidae), Delphinapterus leucas. В свою очередь у семейства T.chinensis (семейство Tupaiidae) идентичны нуклеотидные последовательности с Delphinapterus leucas. У Vicugna pacos (семейство Camelidae) с Delphinapterus leucas. Наименьшая идентичность нуклеотидной последовательности отмечается у Vicugna pacos (семейство Camelidae) с Cervidae, Bovidae и T.chinensis (семейство Tupaiidae). Нижний предел идентичности нуклеотидной последовательности в области каталитического центра для анализируемых представителей семейств составляет 74%, а аминокислотной – 71%. Верхний предел идентичности нуклеотидной последовательности в области каталитического центра для анализируемых представителей семейств составляет 95%, а аминокислотной – 94%.
Представленность аминокислотного состава Chn носит выраженно видоспецифичный характер - достаточно редко встречаются Trp (1,1-1,3%), Cys (1,5-1,9%), His (1,1-2,6%) и Met (1,8-2,9%), часто – Ser (8,2-11,0%), Gly (7,9-9,2%), Val (7,1-9,0%) и Leu (8,0-9,5%). Общий показатель консервативности по аминокислотному составу каталитического участка в положении 25 - 220 составляет 67% (118 идентичности из 175).
В ходе филогенетического анализа на дендрограмме, построенной для нуклеотидной последовательности гена химозина, можно выделить клады шести клад:
- клада I состоит из трёх видов семейства Camelidae (C. Dromedaries, Camelus ferus, Vicugna pacos);
- клада II включает три вида семейства Cervidae (A. Alce, C. Canadensis, C. pygargus);
- клада III – входят 5 видов семейства Bovidae, образующие две подгруппы.
В целом топология дерева трех групп соответствует топологии деревьев, построенных для других участков генома видов отряда Cetartiodactyla.
Отдельно стоят группы:
- клада IV – семейство Delphinapterus leucas;
- клада V – Muridae (семейства R.norvegicus)
- клада VI – T.chinensis (семейство Tupaiidae).
Таким образом, выявлен широкий спектр как различий, так и сходства анализируемых параметров гена и белка Chn у исследуемых представителей семейств, которое по всей видимости определяется средой обитания, рационом питания, терморегуляцией организма и участием Chn в пассивном переносе материнского IgG, согласно «иммунной гипотезе». Выявленные замены, спектр и представленность аминокислот как в целом в белке, так и в области каталитического центра, могут влиять на связывание фермента с κCS и, следовательно, на каталитическую активность.
