EFFECT OF SDHB: P.M103V MUTATION ON PROTEIN STRUCTURE AND DYNAMICS
EFFECT OF SDHB: P.M103V MUTATION ON PROTEIN STRUCTURE AND DYNAMICS
Abstract
Head and neck paragangliomas are rare neuroendocrine tumours with a high inheritance rate (about 40%) and are often associated with mutations in SDHx genes. Vagal paraganglioma (VPG) develops from a paraganglion located along the vagus nerve and occurs in 13% of head and neck paragangliomas. Among all paragangliomas/pheochromocytomas, HPG is the most aggressive tumour and metastasizes most frequently, and due to the rarity of the disease, the genetics of HPG are understudied. Previously, we identified a missense variant p.M103V in the SDHB gene with uncertain clinical significance in a study sample of 36 IDPs. In this work, an analysis of the effect of the identified SDHB: p.M103V mutation on protein structure and dynamics was performed using molecular dynamics modelling. It is shown that this mutation causes severe structural changes and can lead to impairment of protein stability and function. Thus, the negative effect of the p.M103V variant on the structure/function of the SDHB subunit, as well as the association with paragangliomas/pheochromocytomas and other tumour syndromes, indicate its likely pathogenicity.
1. Введение
Параганглиомы и феохромоцитомы являются опухолями параганглиев – органов вегетативной нервной системы. Параганглии разделяют на хромаффинные, относящиеся к адреналовой системе и способные к секреции, и нехромаффинные, выполняющие функцию хеморецепторов. Феохромоцитомы развиваются из наиболее крупного симпатического параганглия – мозгового вещества надпочечников. Парасимпатические параганглиомы преимущественно формируются в области головы и шеи; в зависимости от места локализации выделяют каротидные, вагальные и параганглиомы среднего уха. Вагальные параганглиомы (ВПГ) являются наиболее редкими и мало изученными, эти опухоли составляют 13% от всех параганглиом головы и шеи . ВПГ характеризуются самым высоким метастатическим потенциалом (16-19%) среди всех параганглиом/феохромоцитом . Мультифокальные формы ВПГ, которые часто образуются совместно с каротидными параганглиомами и располагаются с одной или с обеих сторон шеи, могут возникать в 30-40% случаев при семейных формах опухолей . На протяжении многих десятилетий хирургическое удаление параганглиом головы и шеи является основным методом лечения, которое сопряжено с серьезными послеоперационными осложнениями . В случае неоперабельных или метастазирующих опухолей также применяют лучевую и химиотерапию, однако эти методы имеют низкую эффективность . На сегодняшний день крайне актуальными являются вопросы, касающиеся молекулярной основы развития параганглиом головы и шеи, поиска новых эффективных диагностических и прогностических биомаркеров и мишеней для терапии.
Важной особенностью параганглиом/феохромоцитом является их высокая степень наследуемости по сравнению с другими злокачественными новообразованиями человека. Около 40% этих опухолей ассоциированы с наследственными мутациями как минимум в одном из 15 известных генов предрасположенности . Примерно в 30% случаев опухоли с такими мутациями возникают как проявление наследственных опухолевых синдромов. Параганглиомы головы и шеи чаще всего связаны с мутациями в генах SDHх (SDHA, SDHB, SDHC и SDHD), кодирующих соответствующие субъединицы сукцинатдегидрогеназы (SDH) . Наличие мутаций в этих генах может приводить к состоянию псевдогипоксии и гиперметилирования, а также связано с более агрессивным поведением опухоли (мультифокальный рост, рецидив и метастазирование) . Выявление патогенных/вероятно патогенных мутаций в генах SDHx имеет высокую диагностическую и прогностическую значимость для ведения пациентов с параганглиомами/феохромоцитомами.
В данном исследовании, нами проведено моделирование молекулярной динамики варианта p.M103V в гене SDHB, идентифицированного у пациента с ВПГ. На сегодняшний день, клиническая значимость варианта SDHB: p.M103V является неопределенной. Результаты анализа влияния p.M103V на структуру и динамику субъединицы SDHB в комплексе сукцинатдегидрогеназы могут помочь в определения патогенности этой мутации.
2. Методы и принципы исследования
2.1. Создание гомологичной модели
Гомологичная модель субъединицы SDHB создана из известной аминокислотной последовательности белка с помощью пакета программ Modeller . В качестве референса использовалась структура сукцинатдегидрогеназы свиньи PDB ID:1ZOY (разрешение 2,4 Å). Гомологичные структуры белка дикого типа и белка с исследуемой мутацией SDHB: NM_003000: c.A307G, p.M103V (chr1: 17355211, rs140178341) сконструированы на основе выравнивания двух аминокислотных последовательностей белков человека, а также PDB структуры референсной 3D модели.
2.2. Создание полноатомной системы
С помощью графического конструктора CHARMM-GUI создана полноатомная система, состоящая из участка мембраны и интегрированного мембрано-протеинового SDH комплекса, необходимая для проведения моделирования молекулярной динамики . Исследуемая система создана в силовом поле CHARMM36. Система помещена в раствор, соответствующий физиологическому (0.15M NaCl, pH = 7), параметризован кофактор убихинон (UQ), а также железо-серные (2Fe-2S) кластеры (длины связей, константы жесткости связей, значения простых и двугранных углов и др.).
2.3. Моделирование молекулярной динамики
Запуск моделирования молекулярной динамики системы проведен с использованием пакета программ GROMACS . Температура процесса моделирования составила T = 303.15 K. Термостатирование динамики проводилось с помощью расширенного ансамбля Nose-Hoover и временной постоянной равной 1 пс, определяющей период флуктуации температуры при равновесии. Баростатирование проводилось с помощью ансамбля Parrinello-Rahman и временной постоянной равной 5 пс. Система для молекулярной динамики была помещена в ячейку с размером 10,63х10,63х20,20 нм, заполнена молекулами воды (TIP3P) с добавлением ионов хлора и натрия до концентрации 0,15 М и нейтрального суммарного заряда системы. Временной шаг интегрирования составил 2 фс.
2.4. Анализ и визуализация данных
Обработка данных проводилась в Python с использованием программного пакета NumPy . Построение графиков выполнено с помощью Matplotlib . Для визуализации структур использовали программный пакет PyMol .
3. Результаты и обсуждение
В исследуемой выборке вагальных параганглиом у одного из 36 пациентов идентифицирована миссенс мутация NM_003000: c.A307G, p.M103V (chr1: 17355211, rs140178341) в гене SDHB. Эта мутация была ранее зарегистрирована в базах данных dbSNP и ClinVar и выявлена в результате клинического тестирования при таких заболеваниях как параганглиомы/феохромоцитомы, стромальные опухоли желудочно-кишечного тракта, синдром Карни-Стратакиса, синдром Каудена, наследственный опухолевый синдром. Происхождение этой альтернативной аллели имело статус либо герминальный, либо неустановленный. На данный момент клиническая значимость варианта SDHB: p.M103V остается неопределенной.
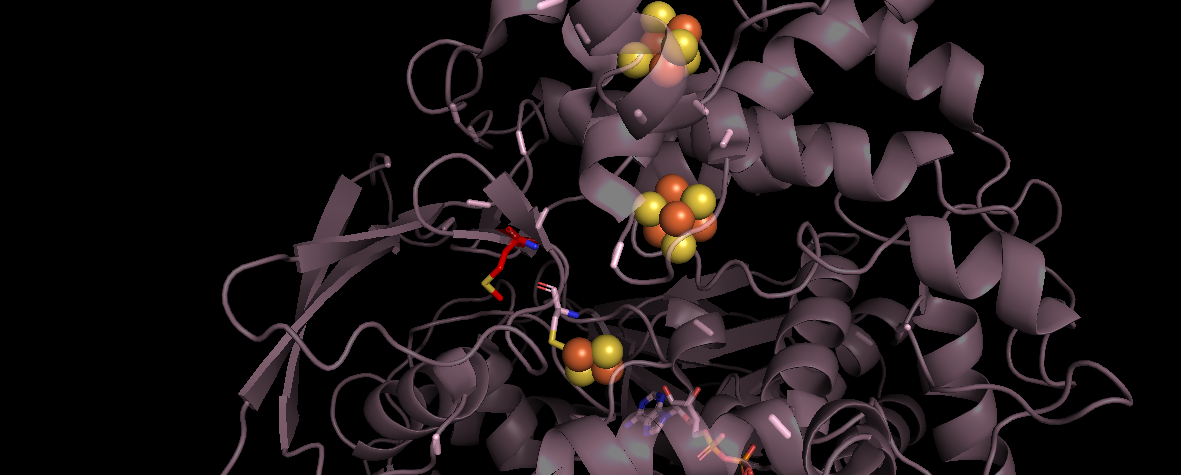
Рисунок 1 - Положение метионина 103 в субъединице SDHB
Примечание: палочки, красный – Метионин 103; шарики, желто-оранжевый – 2Fe-2S кластеры
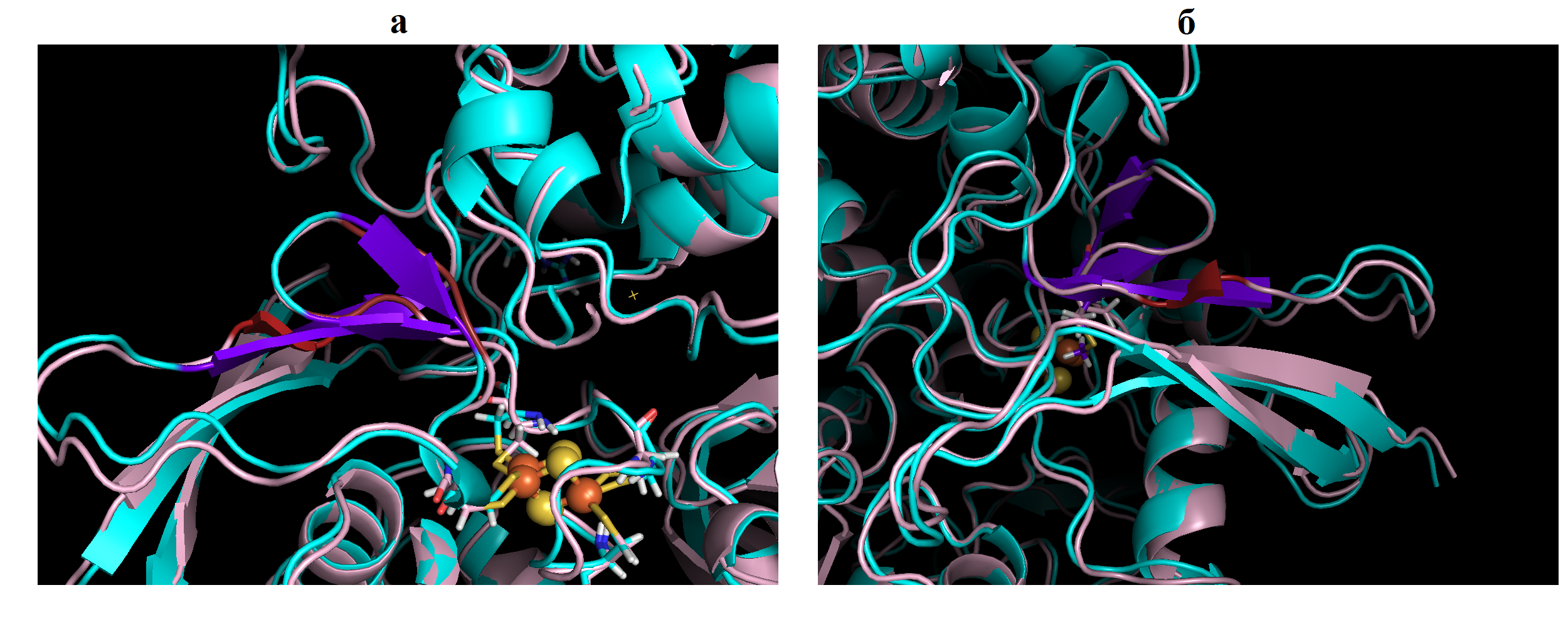
Рисунок 2 - Сравнение структуры нативной субъединицы SDHB и субъединицы c мутацией p.M103V
Примечание: голубой – белок дикого типа; розовый – мутантный белок; фиолетовый – бета-листы в структуре нативного белка; красный – бета-листы в структуре мутантного белка; шарики, желто-оранжевый – 2Fe-2S кластеры; а и б – разный ракурс в пространстве
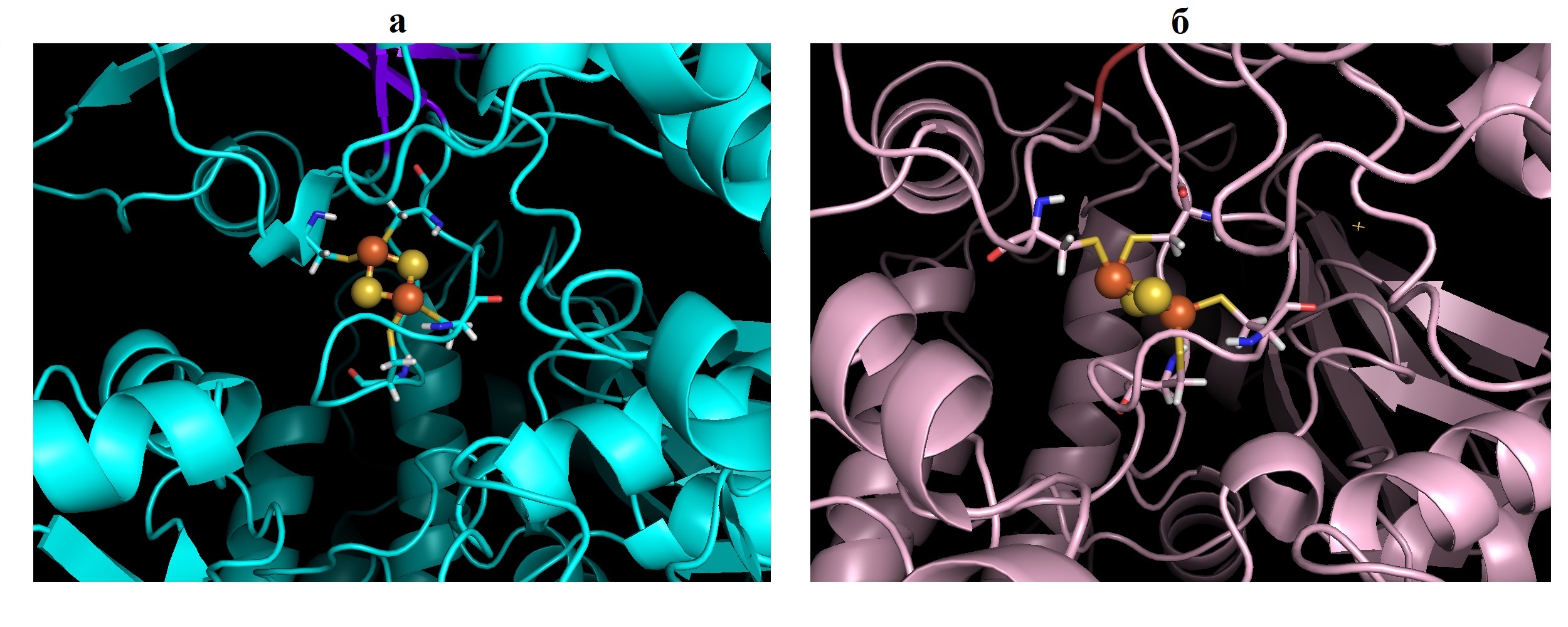
Рисунок 3 - Структура 2Fe-2S кластера нативной субъединицы SDHB (а) и субъединицы c мутацией p.M103V (б)
Примечание: шарики, желто-оранжевый – 2Fe-2S кластеры
Полученные результаты моделирования молекулярной динамики мутации SDHB: p.M103V свидетельствует о ее патогенном эффекте на структуру белка, что также подтверждается многими другими предсказательными алгоритмами. Белок SDHB – это гидрофильная субъединица, содержащая три железо-серных кластера, которая образует границу раздела между каталитическим и мембранным якорным доменами в структуре сукцинатдегидрогеназы . In silico моделирование тетрамерного SDH комплекса показало широкий спектр биохимических последствий мутаций в гене SDHB . Ким с коллегами выявили несколько ключевых последствий SDHB мутаций:
1) полная потеря белка в результате нонсенс-зависимого распада и/или ускоренной деградации мРНК, а также нарушение стабильности и деградация самого белка;
2) нарушение импорта белка в митохондрии;
3) нарушение сборки SDH комплекса;
4) изменение функциональной активности сукцинатдегидрогеназы из-за изменений в активных центрах фермента .
В более ранних работах была продемонстрирована важность железо-серных кластеров импорте субъединицы SDHB в митохондрии и сборке зрелого SDH комплекса , . Таким образом, мы предполагаем, что исследуемая мутация SDHB: p.M103V может приводить к нарушению биогенеза и стабильности белка (нарушение включения 2Fe-2S кластеров в структуру белка), а также сборки SDH комплекса, что как следствие вызывает снижение активности сукцинатдегидрогеназы и способствует развитию заболевания.
4. Заключение
Моделирование молекулярной динамики показало, что мутация NM_003000: c.A307G, p.M103V (chr1: 17355211, rs140178341) вызывает серьезные структурные изменения в субъединице SDHB сукцинатдегидрогеназы, которые могут привести к нарушению ее стабильности и потере функции. Согласно результатам моделирования, данная мутация является вероятно патогенной. Кроме того, идентификация этой мутации у нашего пациента с ВПГ, а также других больных параганглиомами/феохромоцитомами (по данным ClinVar) при низкой популяционной частоте, также указывает на ее патогенный эффект и вовлеченность в развитие заболевания. Полученные результаты расширяют спектр патогенных/вероятно патогенных вариантов, связанных с параганглиомами головы и шеи.
