экспрессионная модель ПРЕДСКАЗАНИЯ мутациЙ в генах SDHX при каротидных параганглиомах
экспрессионная модель ПРЕДСКАЗАНИЯ мутациЙ в генах SDHX при каротидных параганглиомах
Аннотация
Каротидная параганглима (КПГ) – это редкое злокачественное новообразование, которое формируется из клеток парасимпатического параганглия, располагающегося в области бифуркации сонной артерии. КПГ преимущественно характеризуются медленным ростом и бессимптомным течением, однако их сложная анатомическая локализация и высокая степень васкуляризации представляет серьезные проблемы для терапии. Около 40% всех параганглиом головы и шеи ассоциированы с мутациями в генах SDHx. Мутации в этих генах могут быть связаны с наследственными синдромами, а также риском развития метастатических и мультифокальных форм опухолей. Диагностика SDHx мутаций имеет важное значение для ведения пациентов с параганглиомами. В этом исследовании, на основе анализа транскриптомных профилей и данных о SDHx мутациях в образцах КПГ мы провели поиск модели предсказания мутационного статуса этих генов. Поиск модели проводился с использованием полносвязной нейронной сети. В результате создана модель на базе экспрессии пяти генов – GFPT2, GABRG2, KCNA6, PCDH9 и CACNG3 со статистическим показателем AUC 0,92. Таким образом, полученная модель может быть перспективным инструментом для определения мутаций в генах SDHx при КПГ.
1. Введение
Параганглиомы (ПГ) головы и шеи образуются из параганглиев парасимпатической нервной системы с частотой 1 на 100 000 . Наиболее частые места локализации этих опухолей – область бифуркации сонной артерии (каротидные ПГ), область вдоль блуждающего нерва (вагальные ПГ) и среднее ухо (югулотимпанальные ПГ) . Каротидные параганглиомы (КПГ) составляют 60% всех ПГ головы и шеи. Развитие КПГ на начальных этапах часто протекает бессимптомно и проявляется в виде медленно растущего новообразования. Диагностика этих опухолей осуществляется преимущественно с использованием таких инструментальных методов как компьютерная томография, магнитно-резонансная томография и ангиография, однако окончательный диагноз устанавливается только после операции гистопатологическими и иммуногистохимическими методами. Хирургическое удаление признано эффективным и практически единственным способом лечения КПГ, но связано с высоким риском осложнений из-за длительного времени операции, значительной кровопотери и паралича черепно-мозговых нервов .
До 25% КП являются мультифокальными (развиваются с обеих сторон шеи и/или одновременно с другими ПГ), в 4-6% случаев наблюдается метастазирование . Важно отметить, что все ПГ относятся к злокачественным новообразованиям с вариабельным потенциалом метастазирования, который сложно предсказать . На сегодняшний день эффективные биомаркеры, предсказывающие агрессивный фенотип ПГ, не известны. Тем не менее генетические исследования последних лет показали, что наследственные мутации в генах SDHB с высоким риском развития метастатических ПГ головы и шеи, в то время как мутации в генах SDHD ассоциированы с мультифокальными формами опухолей . Мутации в генах SDHx (SDHD, SDHB, SDHC и SDHA) являются самыми частыми (около 40%) среди наследственных ПГ головы и шеи и могут быть связаны с развитием синдромов параганглиом . Эти гены кодируют четыре субъединицы сукцинатдегидрогеназы, которая является важным ферментом цикла Кребса и окислительного фосфорилирования. Предполагают, что одним из ключевых механизмов развития SDHx-ассоциированных ПГ является накопление онкометаболита сукцината, приводящее к активации пути псевдогипоксии, компоненты которого могут быть потенциальными мишенями для противоопухолевой терапии . Высокая частота мутаций в генах SDHx, связь с развитием наследственных синдромов параганглиом и агрессивным поведением опухоли обуславливают необходимость генетического консультирования и тестирование всех пациентов с ПГ, которое также рекомендовано Международным Обществом Эндокринологов .
В данной работе, на основе ранее полученных данных секвенирования транскриптома репрезентативной выборки КПГ, мы разработали модель для предсказания мутаций в генах SDHx. Это исследование важно для развития методов диагностики и оценки прогноза течения заболевания.
2. Методы и материалы исследования
2.1. Набор данных
Для разработки модели использовались данные транскриптомного секвенирования 77 образцов опухолевых тканей КПГ (данные не опубликованы). Подготовка транскриптомных библиотек проводилась с помощью набора TruSeq Stranded Total RNA Library Prep Kit with Ribo-Zero Human/Mouse/Rat фирмы Illumina (США). Секвенирование выполнено на приборе NextSeq 500 System (Illumina) в режиме одноконцевых прочтений длиной 76 нуклеотидов. Первичный биоинформатический анализ выполнялся по стандартной схеме, включающей такие этапы как контроль качества прочтений, обрезка и фильтрация ридов, удаление адаптеров, картирование последовательностей на референсный геном человека (GRCh38.p12), агрегация отчётов, подсчёт числа ридов на ген и импорт данных в среду R. Анализ дифференциальной экспрессии выполнялся с использованием пакета edgeR.
2.2. Поиск модели
Поиск модели проводился с использованием полносвязной нейронной сети (FCNN) и библиотеки Keras. Исследуемая выборка образцов КПГ случайным образом была разделена на обучающий и тестовый наборы данных в соотношении 2:1 с сохранением пропорций сравниваемых групп. В качестве входных данных использовали значение CPM, отражающее нормализованный уровень экспрессии генов. Для построения FCNN были задействованы 5 предикторов в качестве входного слоя, затем построены 7 скрытых слоев и выходной слой, состоящий из двух нейронов. Шаг обучения алгоритма оптимизации составил 0,003. Метриками качества модели во время обучения выбраны чувствительность, специфичность, точность и площадь под ROC-кривой (AUC). Для предотвращения переобучения, модель после прохождения каждой эпохи подлежала сохранению. Количество эпох, дающее максимальное качество модели, считалось оптимальным (но не более 200).
3. Основные результаты
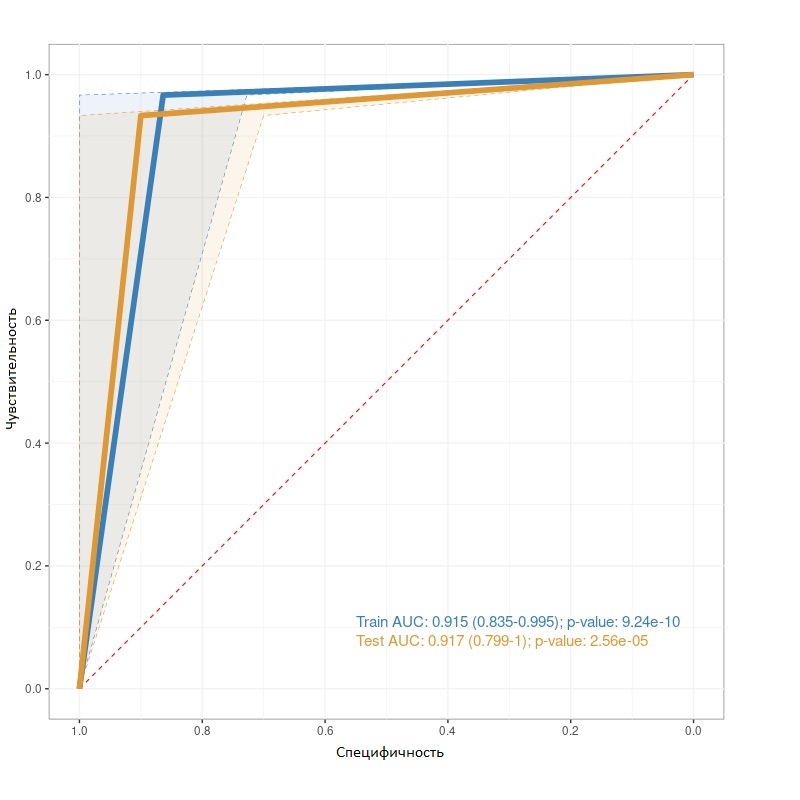
Рисунок 1 - ROC-анализ модели на основе экспрессии генов GFPT2, GABRG2, KCNA6, PCDH9 и CACNG3, предсказывающей наличие SDHx мутаций при каротидных параганглиомах
Примечание: синяя кривая – обучающий набор данных, оранжевая кривая – тестовый набор данных
Таблица 1 - Гены экспрессионной модели, ассоциированные с SDHx мутациями при КПГ
Ген | Кодируемый белок | LogFC | Направление изменения | Значение p (тест Манна-Уитни) |
GFPT2 | Глутамин-фруктозо-6-фосфатаминотрансфераза | 1,38 | ↑ | 0,0004 |
CACNG3 | Субъединица гамма 3 регуляторного белка трансмембранного АМРА-рецептора I типа | 1,21 | ↑ | 0,0002 |
PCDH9 | Протокадгерин 9 | 1,04 | ↓ | 0,00002 |
GABRG2 | Субъединица гамма 2 рецептора гамма-аминомасляной кислоты А | 1,92 | ↓ | 0,0002 |
KCNA6 | Белок Kv1.6 подсемейства калиевых потенциалзависимых каналов | 1,03 | ↓ | 0,0002 |
Примечание: ↑ - повышение экспрессии, ↓ - понижение экспрессии
4. Обсуждение
Идентификация патогенных мутаций в генах, ассоциированных с канцерогенезом, является важным этапом в диагностике и лечении. Этот вопрос широко изучается как в теоретической, так и в прикладной биоимедицине. В связи с наступившей эрой омиксных данных у исследователей появилась возможность проводить более глубокий и разносторонний анализ молекулярно-генетических характеристик опухолей. Эти данные также позволяют разрабатывать новые подходы с высокой предсказательной силой для обнаружения драйверных нарушений. В этой работе, для создания модели предсказания мутаций в генах SDHx мы использовали данные об экспрессии генов и данные о наличии мутаций в исследуемых образцах. В результате разработана модель на основе экспрессии генов GFPT2, GABRG2, KCNA6, PCDH9 и CACNG3, демонстрирующая высокое значение AUC – 0,92, указывающее на качественный алгоритм классификации.
В этиологии ПГ выделяют спорадические и семейные случаи, при этом до 1/3 этих опухолей могут быть ассоциированы с семейными синдромами параганглиом . SDHx мутации вызывают развитие наследственных синдромов параганглиом типов 1 (SDHD), 3 (SDHC), 4 (SDHB) и 5 (SDHA). Мутации в гене SDHA могут приводить к развитию синдрома Ли, характеризующегося подострой некротизирующей энцефаломиелопатией . Соматические мутации в генах SDHx также выявляются в контексте спорадических ПГ . Наследственные ПГ имеют более высокий риск развития метастатических и мультифокальных форм опухолей, тогда как спорадические ПГ характеризуются преимущественно не агрессивным фенотипом и односторонней локализацией . Таким образом, SDHx мутации имеют высокую частоту среди пациентов с ПГ и являются первостепенной генетической характеристикой этих опухолей, определяющей наследуемость заболевания и его клиническое течение.
В настоящее время для генетического тестирования мутаций во всех четырех генах SDHx можно использовать метод полноэкзомного секвенирования или таргетную панель для секвенирования. Оба подхода имеют высокую стоимость и сроки их выполнения могут занимать длительное время, поскольку ячейка для запуска секвенатора имеет определенную емкость и, как правило, с использованием одной ячейки одновременно анализируют большое число образцов, которые собирают от разных пациентов. Поиск соматических мутаций с помощью таргетной панели на гены SDHx используют различные лаборатории при клиниках в США: Логан Хелт, Мэйо, Асанте и др. Компания Illumina предлагает коммерческую панель TruSight Oncology 500, в которую включены 500 различных генов, ассоциированных с опухолями, включая гены SDHx. Также можно проводить анализ индивидуальных генов SDHx с использованием таргетного высокопроизводительного секвенирования или секвенирования по Сэнгеру, пока не удастся выявить мутацию или не будут проверены все четыре гена. Данный подход может быть самым экономичным, если провести предварительный анализ опухолей на наличие мутаций в генах SDHx с использованием экспрессионной модели. Это позволит исключить около 60% случаев опухолей, не связанных с мутациями в этих генах. Кроме того, модель можно использовать для классификации КПГ на SDHx-мутантные и не мутантные опухоли для изучения молекулярно-генетических особенностей развития заболевания.
5. Заключение
Полученная модель является перспективным инструментом для определения мутаций в генах SDHx при КПГ для научно-исследовательских целей с использованием полнотранскриптомных данных. Кроме того, результаты этого исследования могут в дальнейшем получить развитие в клинике для более экономичного скрининга на носительство SDHx мутаций у пациентов с КПГ методом количественной ПЦР.
