Relative representation of bacterial families in pancreatic ductal adenocarcinoma tissue depending on its degree of differentiation
Relative representation of bacterial families in pancreatic ductal adenocarcinoma tissue depending on its degree of differentiation
Abstract
Pancreatic ductal adenocarcinoma (PDAC) is characterised by an extremely adverse prognosis, and the intratumoural microbiome is seen as one of the key factors in its modulation. In this study, 16S sequencing was used to perform microbiome profiling of PDAC tumours with varying degrees of differentiation. As a result, specific bacterial signatures were identified: for highly differentiated (Carnobacteriaceae, Bdellovibrionaceae, Alicyclobacillaceae), moderately differentiated (Xanthomonadaceae, Pseudonocardiaceae), and poorly differentiated (Gemellaceae, Pasteurellaceae, Bacillaceae) PDAC. The identified associations provide a foundation for the development of innovative methods for the diagnosis, prognosis, and treatment of PDAC.
1. Введение
Протоковая аденокарцинома поджелудочной железы (PDAC) — одно из наиболее летальных онкологических заболеваний, характеризующееся крайне низкой пятилетней выживаемостью (5–7%)
. Такой неблагоприятный прогноз обусловлен трудностями ранней диагностики и высокой агрессивностью течения. Прогрессирование и метастазирование PDAC связаны с множеством факторов, среди которых важную роль играет опухолевый микробиом , . Он участвует в формировании опухолевой микросреды, влияя на сигнальные пути как в стромальных, так и в раковых клетках , , . Однако механизмы, с помощью которых это сложное взаимодействие модулирует внутриклеточную сигнализацию в клетках PDAC, остаются недостаточно изученными. Кроме того, взаимосвязь между структурными изменениями опухоли, ее прогрессией и составом микробиома до сих пор не была предметом целенаправленного исследования.В данном исследовании на основе секвенирования 16S рРНК проведен сравнительный анализ интратуморального микробиома протоковой аденокарциномы поджелудочной железы с целью выявления бактериальных сообществ, ассоциированных с различной степенью дифференцировки опухоли. Полученные данные имеют потенциальную ценность для разработки новых диагностических и прогностических подходов.
2. Методы и принципы исследования
2.1. Коллекция опухолевых образцов
Собрана коллекция образцов опухолевых FFPE тканей от пациентов с аденокарциномой поджелудочной железы на базе института хирургии им. Вишневского. Все материалы были собраны и охарактеризованы патологоанатомическим отделением организации в соответствии с WHO classification of tumors of the pancreas
. Каждый образец опухоли содержал минимум 70% опухолевых клеток. Этическая экспертиза и одобрение не потребовались, поскольку текущее исследование представляло собой ретроспективное исследование с использованием медицинских записей/биологических образцов, полученных в ходе предыдущей клинической практики. Состав выборки указан в Таблице 1.Таблица 1 - Клинические и патологические характеристики пациентов с PDAC
Характеристика | Количество, n |
Общее количество пациентов | 28 |
Пол | |
женский | 14 |
мужской | 14 |
Grade | |
G1 | 4 |
G2 | 12 |
G3 | 12 |
2.2. Выделение ДНК
При помощи набора ExtractDNA FFPE (Evrogen, Россия) с адаптациями (увеличение времени инкубации на 56 градусах до 24 часов) выделена тотальная ДНК из FFPE образцов опухолей. Контроль включает в себя следующие образцы: куски парафина с исходных парафиновых блоков, мазки с рабочих инструментов и поверхностей в институте хирургии им. Вишневского, мазки с рабочих инструментов и поверхностей в лаборатории, контроль выделения ДНК, контроль подготовки библиотек. ДНК из мазков выделялась набором ДНК-сорб Б (Amplisens, Россия). Проведена качественная и количественная оценка выделенных образцов на приборе Nano Drop 1000 и Qubit 4 (Invitrogen, США), соответственно.
2.3. Подготовка 16s библиотек
Чтобы обеспечить более высокую точность определения таксонов в деградированных образцах с малой микробной биомассой использовался мультиплексированный 16S протокол секвенирования рДНК, который поднимает пять 16S коротких областей (V2, V3, V5, V6, V8), чтобы увеличить охват и разрешение обнаружения видов бактерий (длина фрагментов 250-400 bp). При помощи MULTIPLEX TCR PCR Mix (МайЛаборатори, Россия) выполнена подготовка ампликонных библиотек со специальными мультиплексными праймерами. По 0.2µM каждого праймера на реакцию:
F1-TGGCGAACGGGTGAGTAA,
F2- ACTCCTACGGGAGGCAGC,
F3-GTGTAGCGGTGRAATGCG
F4-GGAGCATGTGGWTTAATTCGA,
F5-GGAGGAAGGTGGGGATGAC,
R1-AGACGTGTGCTCTTCCGATCTCCGTGTCTCAGTCCCARTG,
R2-AGACGTGTGCTCTTCCGATCTGTATTACCGCGGCTGCTG,
R3-AGACGTGTGCTCTTCCGATCTCCCGTCAATTCMTTTGAGTT,
R4-AGACGTGTGCTCTTCCGATCTCGTTGCGGGACTTAACCC,
R5-AGACGTGTGCTCTTCCGATCTAAGGCCCGGGAACGTATT.
Для поднятия коротких последовательностей 5R участка бактериальной рРНК, индексирование производилось специфическими индексами. По 0.2µM каждого праймера:
FF1-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTTGGCAACGGGTGAGTAA,
FF2-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTACTCCTACGGGAGGCAGC,
FF3-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTGTGTAGCGGTGRAATGCG,
FF4-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTGGAGCATGTGGWTTAATTCGA,
FF5-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTGGAGGAAGGTGGGGATGAC.
И один баркодспецифичный 8 нуклеотидный обратный праймер (0.4µM, RR5-CAAGCAGAAGACGGCATACGAGAT-NNNNNNNN-GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT). Концентрация готовых библиотек измерена на приборе Qubit 4 (Invitrogen, США) с использованием набора Qdye HS для определения количества двуцепочечной ДНК (Lumiprobe, Россия). Библиотеки смешаны эквимолярно в пул, качество библиотек проверено на приборе Qsep 1 Plus (Qsep, Тайвань). Секвенирование библиотек произведено на приборе MiSeq (Illumina, США) в режиме парно-концевых прочтений (150×2) с использованием набора MiSeq Reagent Kit v2 (300 cycles).
2.4. Биоинформатический анализ данных
Полученные прочтения вычислительно объединены в длинные ампликоны с использованием Short MUltiple Regions Framework (SMURF) и базы данных Greengenes. Чтобы улучшить таксономическое назначение, использовался классификатор рибосомальной базы данных (RDP). Относительная численность преобразована в количество прочтений путем умножения на общее количество прочтений. Прочтения образцов нормализованы в каждой библиотеке секвенирования с помощью коэффициента, представляющего отношение среднего количества прочтений образца в конкретной библиотеке к общему среднему значению по библиотекам. Образцы с менее чем 1000 нормализованными прочтениями (включая отрицательный контроль) и виды с относительной численностью менее 10-4 исключены из дальнейшего анализа.
Полученные данные пропустили через серию из 5 фильтров для обнаружения и удаления загрязнения:
- Фильтр 1 — удаление видов, которые имеют высокую распространенность в отрицательном контроле.
- Фильтры 2–4 — удаление менее распространенных загрязнений (которые могут быть вызваны более редкими случаями заражения, происходящими во время обработки, или перекрестными загрязнениями между образцами). Сравнена распространенность таксонов в образцах с их распространенностью в контроле. Сравнения распространенности таксонов в исследуемых образцах и контрольных образцах проведены для каждого состояния, для каждой партии, образцы сравнивались из одного и того же состояния с контролями, которые обрабатывались вместе с ними: партия выделения ДНК (фильтр 2), партия ПЦР-амплификации (фильтр 3) и партия библиотеки секвенирования (фильтр 4).
- Фильтр 5: сравнение распространенности таксонов во всех образцах для каждого состояния с их распространенностью в наборе пустых контрольных парафиновых блоков.
2.5. Statistical Analysis
Показатели альфа и бета разнообразия выборки (энтропия Шеннона, индекс преобладания Бергера–Паркера, прямой и обратный индексы Симпсона, индекс Джини–Симпсона, индекс Chao1, индекс Брея-Кертиса и Жаккара) были получены с использованием пакета vegan package (v2.5.6) (OKSANEN J. vegan: Community EcologyPackage. R package version 2.0-2 //http://CRAN. R-project. org/package= vegan. – 2011.). Для определения «повышенного содержания» таксонов в группах G1-G3 использовался програмный пакет ANCOM-BC и выбирались таксоны, с |logFC| > 1 и q-value (поправка Бенджамини-Хохберга) < 0.05. Статистическая значимость в альфа-разнообразии была оценена тестами ANNOVA и Kruskal-Wallis c пороговым значением p < 0.05.
3. Основные результаты
Собрана и охарактеризована выборка из FFPE образцов PDAC (Таблица 1). Из первоначальных 29 образцов FFPE, подвергнутых анализу микробиома 16S, 28 были признаны пригодными для дальнейшего последующего анализа. Один из образцов был исключен из-за наличия считываний митохондриальной последовательности. В составе выборки представлены высокодифференцированные опухоли от 4 пациентов, умеренно дифференцированные — от 12 пациентов и низко дифференцированные от 12 пациентов.
Получены данные секвенирования нескольких типов отрицательного контроля: образцы с разных поверхностей и оборудования в лабораториях патологической анатомии и молекулярной генетики, 159 парафиновых контролей (парафиновые области без ткани) и контроль с этапов выделения ДНК (пустые), ПЦР и очистки (без шаблона). Эти данные были объединены в негативный контроль. Выявленные семейства бактерий и их относительное обилие в отрицательных контролях показаны на Рис. 1. Вклад контаминации очень высок. Основные контаминанты — бактерии семейств Moraxellaceae, Microbacteriaceae, Enterobacteriaceae, Propionibacteriaceae, Deinococcaceae, Gordoniaceae.
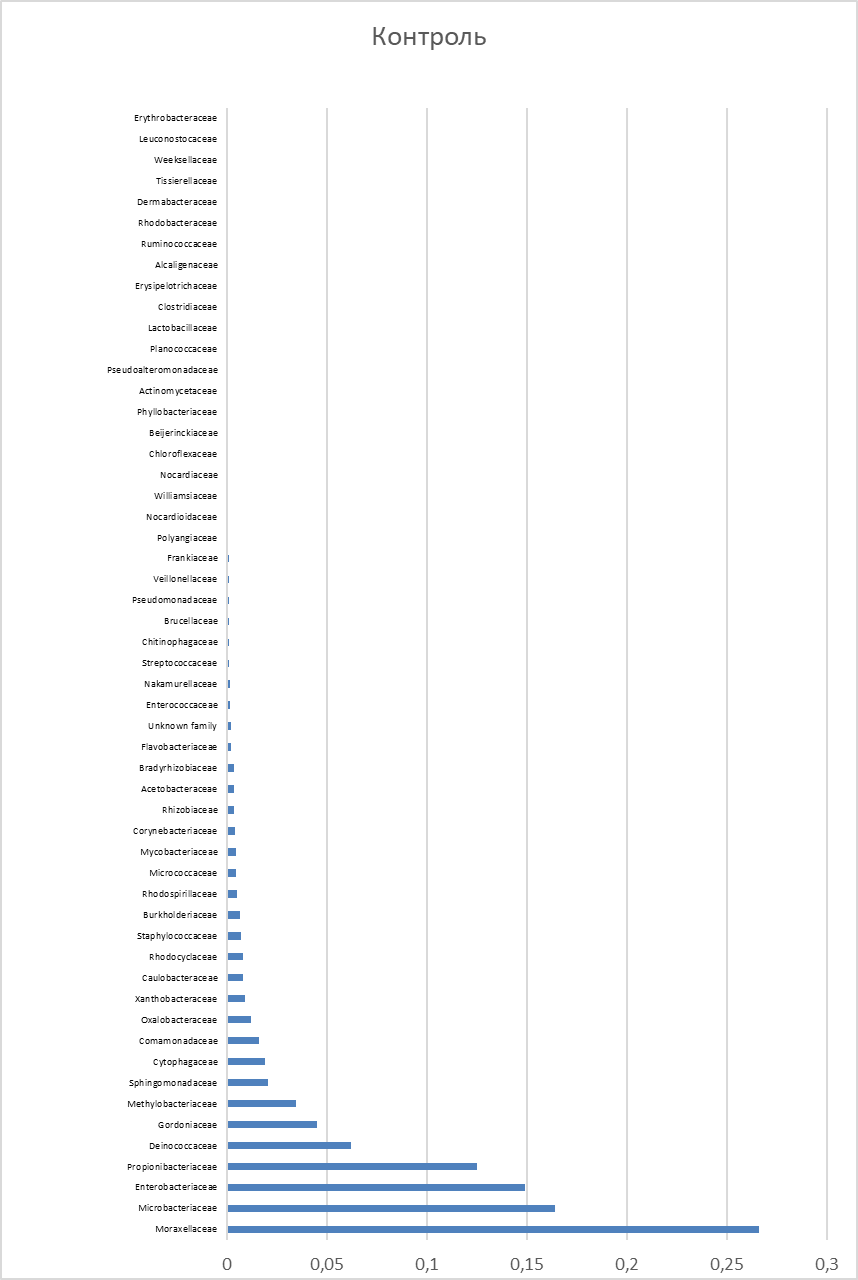
Рисунок 1 - Относительное распределение бактериальных семейств в контроле
При анализе относительного содержания бактерий на уровне семейства идентифицировано присутствие семейств в G1 опухолях: Cellulomonadaceae, в G2 опухолях: Micromonosporaceae, в G3 опухолях: Promicromonosporaceae, Sinobacteraceae. При сравнении бактериального состава в опухолях разной степени дифференцировки было обнаружено повышенное содержание в G3: Gemellaceae, Pasteurellaceae, Bacillaceae, повышенное содержание в G2: Xanthomonadaceae, Pseudonocardiaceae, повышенное содержание в G1: Carnobacteriaceae, Bdellovibrionaceae, Alicyclobacillaceae (Рис. 2).
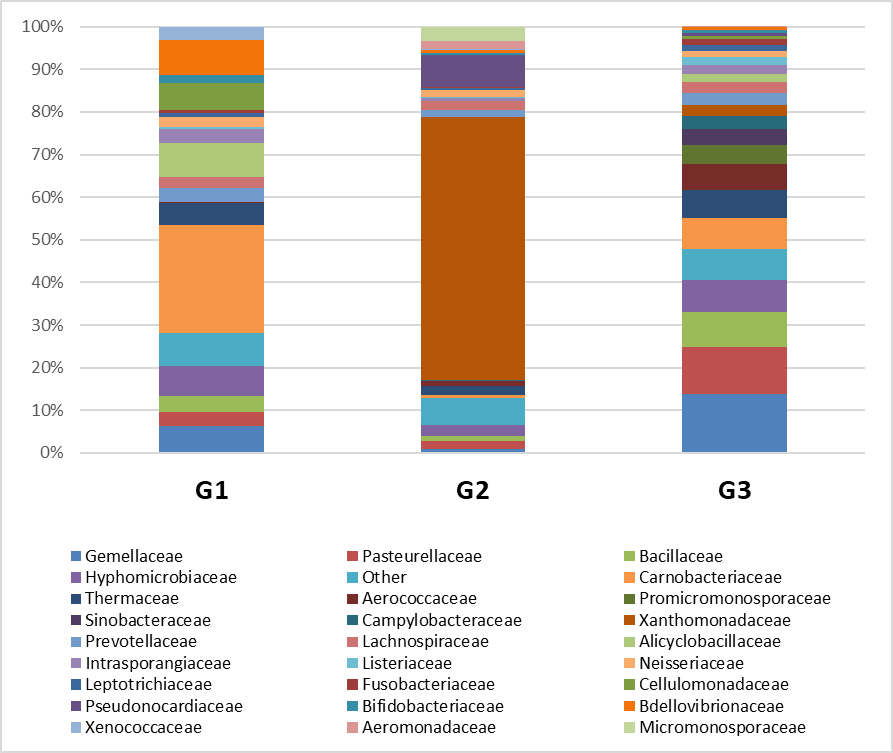
Рисунок 2 - Относительное содержание бактерий при PDAC по степени дифференцировки на уровне семейства
Примечание: топ 30 семейств
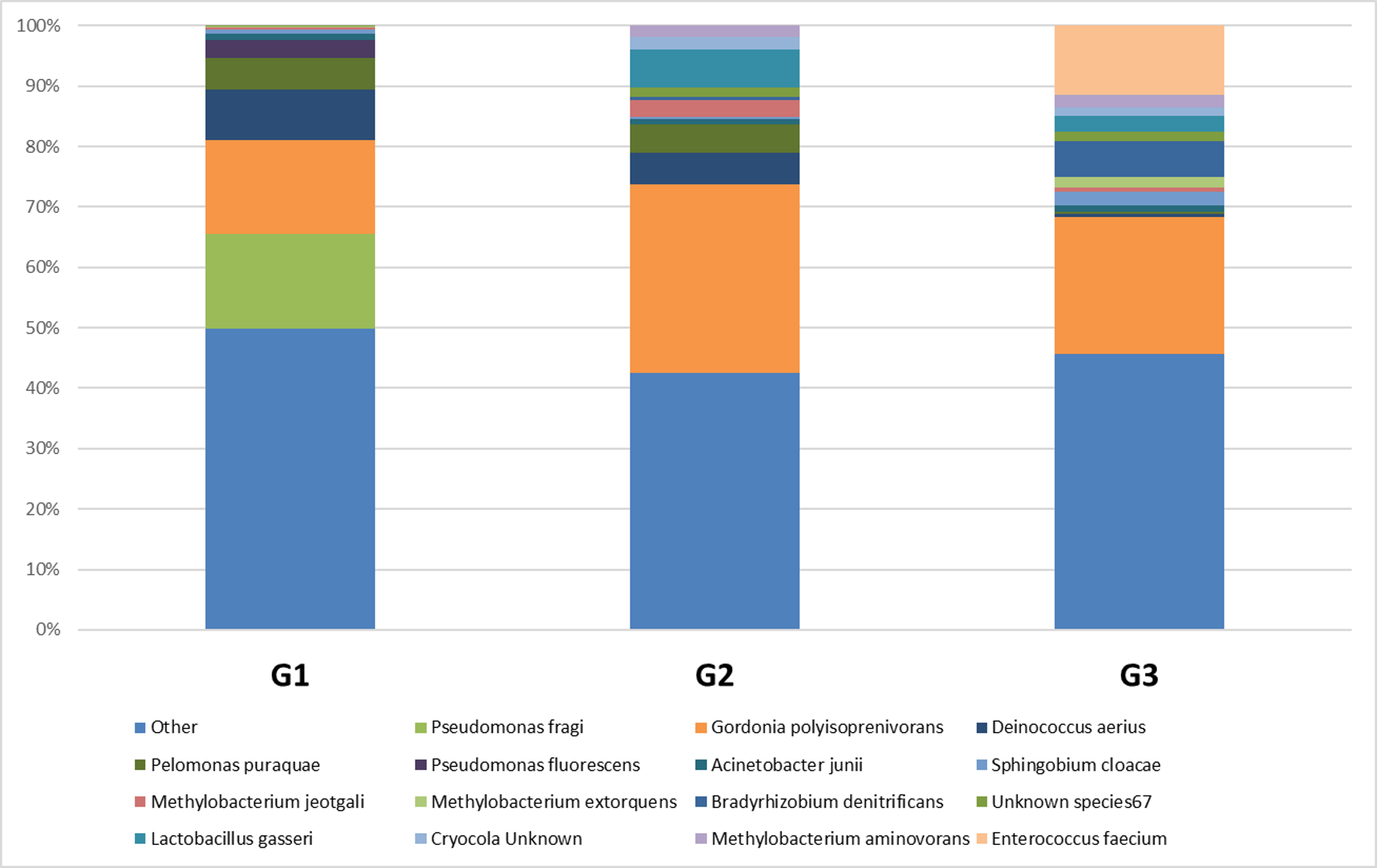
Рисунок 3 - Относительное содержание бактерий при PDAC по степени дифференцировки на уровне вида
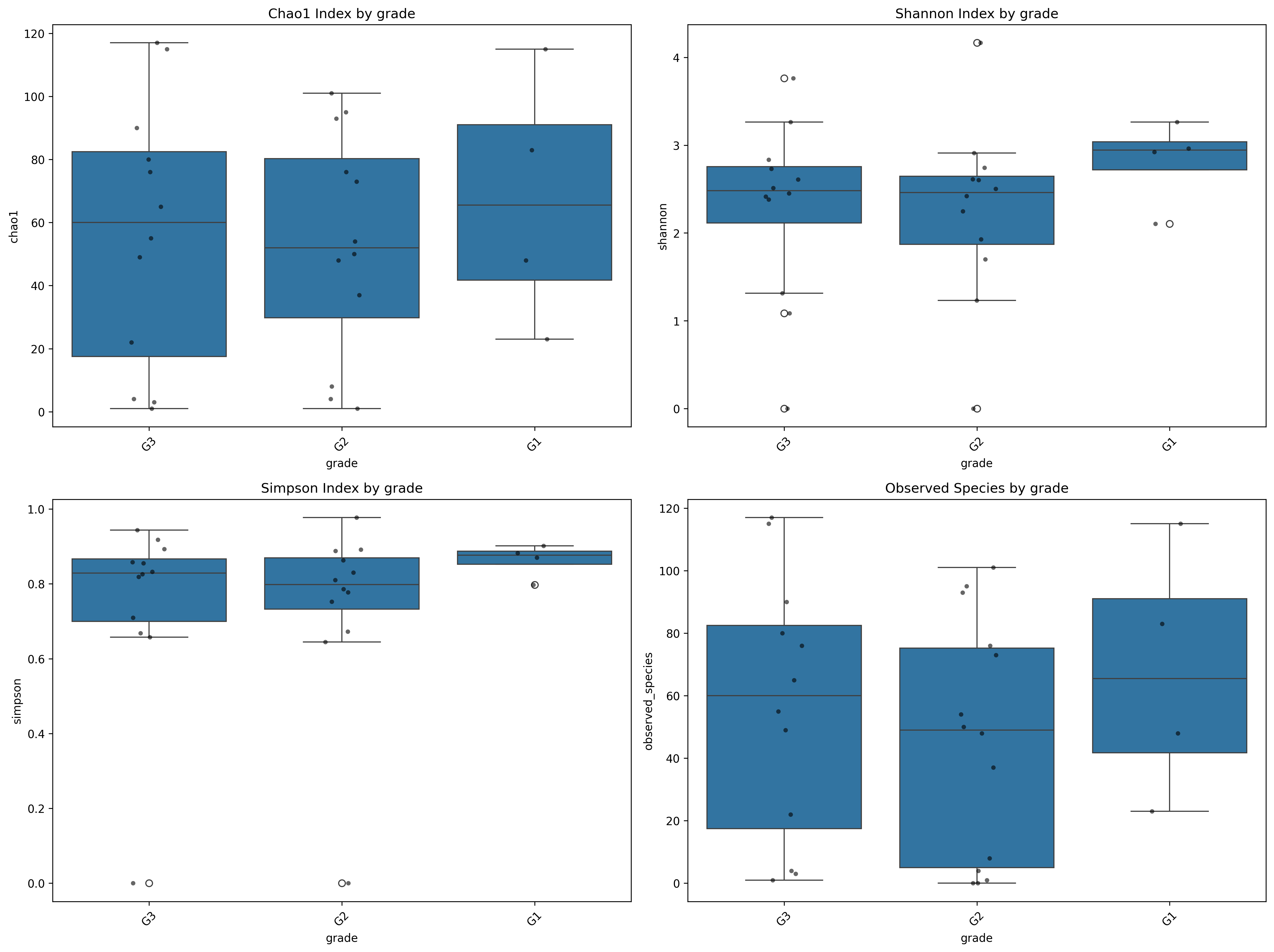
Рисунок 4 - Оценка альфа-разнообразия
Примечание: Тесты Симпсона, Шеннона и Chao1
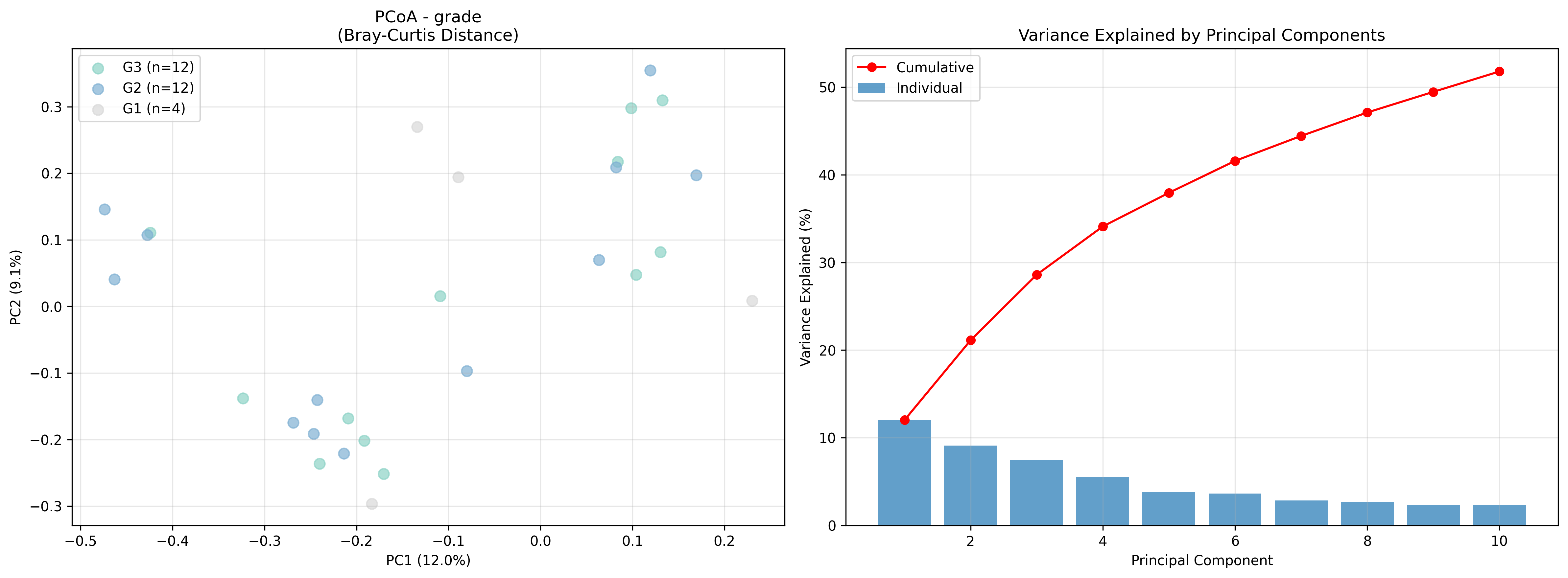
Рисунок 5 - График PCoA, демонстрирующий структуру микробного сообщества
4. Обсуждение
Рак поджелудочной железы представляет собой одну из самых сложных проблем современной онкологии, а его микробное наполнение — возможно, самый неожиданный и перспективный ключ к ее решению. Когда речь заходит о факторах, определяющих агрессивность PDAC, традиционно рассматриваются генетические мутации (например, в гене KRAS ) и особенности гистологического строения опухоли
. Предполагается, что микробиом опухоли не просто «сосуществует» с ней, а активно модулирует ее микроокружение, влияя на ключевые биологические процессы, которые в итоге отражаются на ее гистологической градации (степени агрессивности) , , . Потенциально, определенные бактерии могут способствовать переходу опухоли к более низкой дифференцировке, а значит и к более высокой злокачественности. Предполагаемые механизмы такого перехода: бактерии запускают процесс хронического воспаления в микроокружении опухоли , микробиом может поляризовать иммунные клетки внутри опухоли в сторону иммуносупрессивного фенотипа, что позволяет низкодифференцированным, агрессивным клеткам ускользать от контроля и активно делиться, и бактерии и их метаболиты могут напрямую влиять на сигнальные пути опухолевых клеток (Например, NF-κB ), стимулируя их неконтролируемый рост и выживание , , . В результате нашей работы были идентифицированы уникальные таксоны, характерные для каждой степени дифференцировки PDAC.Так, Cellulomonadaceae встречается исключительно в опухолях G1 и представляет собой грамположительное семейство в порядке Lactobacillales. Это семейство производит молочную кислоту и обладает противовоспалительными свойствами
, , . Присутствие Cellulomonadaceae в хорошо дифференцированных опухолях может быть связано со снижением воспалительной микросреды, что коррелирует с более медленным прогрессированием опухоли, характерным для рака степени G1.Кроме того, Carnobacteriaceae, Bdellovibrionaceae и Alicyclobacillaceae демонстрируют повышенное содержание в опухолях G1. Carnobacteriaceae — грамположительные молочнокислотные бактерии, известные своим противовоспалительным потенциалом и способностью модулировать иммунные реакции посредством продукции IL-10 и регуляции пути NF-κB
, . Bdellovibrionaceae — это хищные бактерии (виды Bdellovibrio), которые питаются грамотрицательными бактериями и потенциально функционируют как естественные агенты биологического контроля в микробиоте опухоли, поддерживая баланс микробиоты без сильных воспалительных реакций .Для G2 опухолей характерно присутствие бактерий семейства Micromonosporaceae, которые являются частью класса актинобактерии, известных производством биологически активных соединений. Это семейство продемонстрировало противоопухолевые свойства благодаря производству вторичных метаболитов, обладающих противораковым действием в отношении различных линий раковых клеток
, . Наличие Micromonosporaceae в опухолях G2 может отражать промежуточное состояние между защитными антимикробными функциями и проопухолевыми механизмами.В опухолях G2 наблюдается повышенное содержание Xanthomonadaceae и Pseudonocardiaceae. Xanthomonadaceae — грамотрицательные организмы окружающей среды, которые при определенных условиях могут действовать как условно-патогенные микроорганизмы, потенциально способствуя дисбактериозу и создавая провоспалительную микросреду, связанную с прогрессированием рака
, . Pseudonocardiaceae — актинобактерии, способные продуцировать различные биологически активные соединения, которые могут влиять на иммунную модуляцию опухоли и метаболические пути .Promicromonosporaceae и Sinobacteraceae уникальным образом идентифицируются в опухолях G3. Хотя эти семейства менее широко описаны в литературе, Promicromonosporaceae принадлежат к типу Actinobacteria и могут производить соединения, влияющие на прогрессирование опухоли, отмечается повышенное присутствие при раке молочной железы
. В то время как Sinobacteraceae могут способствовать воспалительному дисбактериозу. Sinobacteraceae потенциальный драйвер колоректального рака, обладающий проканцерогенными свойствами, такие как выработка соединений, повреждающих ДНК, нарушение функции белка-супрессора опухолей и индукция воспалительной реакции хозяина , .Увеличение количества Gemellaceae, Pasteurellaceae и Bacillaceae в опухолях G3 характеризует агрессивный фенотип опухоли. Gemellaceae — грамположительные кокки, естественно встречающиеся в полости рта, которые могут способствовать воспалению, способствующему развитию опухолей, путем рекрутирования иммунных клеток
, , , . Также повышенное содержание бактерий из семейства Gemellaceae указывает на риск сокращения общей выживаемости при немелкоклеточном раке легкого . Pasteurellaceae, включая такие роды, как Haemophilus, представляют собой грамотрицательные бактерии, связанные с патогенными свойствами и воспалительными реакциями посредством активации Toll-подобных рецепторов и липополисахарид-опосредованной сигнализации. Эти организмы требуют факторов NAD+ и могут модулировать дифференцировку макрофагов в сторону иммуносупрессивных фенотипов , .Bacillaceae включают в себя различные грамположительные и грамотрицательные виды, которые могут продуцировать токсины и активные формы кислорода (ROS), вызывая мутации ДНК и активируя проопухолевые сигнальные пути. Это семейство связано с усилением воспалительных реакций и стимулированием пролиферации опухолевых клеток
.Данное исследование имеет ограничения, на текущий момент, исследование не позволяет оценить диагностическую точность, полученных бактериальных сигнатур, это требует независимой валидации в проспективных когортах с большим размером выборки. Размер выборки в этом исследовании слишком мал, чтобы сделать более убедительный вывод. Исключение таксонов, обнаруженных в контрольных образцах, также может иметь ограничения, поскольку широко распространенные бактерии могут присутствовать как в контрольном, так и в исследуемом образце, не подвергаясь загрязнению в результате работы с образцом. Кроме того, поскольку забор микробов проводился из отдельных участков опухоли, они могут не отражать всего микробного разнообразия опухоли.
5. Заключение
Выявление специфических бактериальных таксонов, ассоциированных с гистологическими типами опухоли, открывает перспективы для изучения их взаимодействия с клетками PDAC и их регуляции. Нам удалось идентифицировать уникальный микробиомный профиль для опухолей разной степени дифференцировки, и установить, что каждое бактериальное сообщество может вносить свой вклад в формирование особых метаболических и иммунных микросред, характерных для опухолей различной степени агрессивности. В качестве следующего шага мы планируем валидацию этих ассоциаций, что является необходимым условием для последующего изучения причинно-следственных механизмов и оценки потенциала микробиомных маркеров для клинического применения. Это сформирует основу для создания новых диагностических, прогностических и терапевтических стратегий.
