Influence of pre-freezing regimes on lyophilisation efficiency and activity of collagenase-based drug
Influence of pre-freezing regimes on lyophilisation efficiency and activity of collagenase-based drug
Abstract
The effect of different pre-freezing methods on the efficiency of subsequent lyophilisation of collagenase type I and preservation of its enzymatic activity was studied. The main focus was on the comparison of four freezing regimes: slow (-20°C), fast (-80°C), ultrafast (liquid nitrogen, -196°C) and controlled in the lyophiliser (1°C/min to -50°C). The primary and secondary drying steps were identical for all samples. Enzyme activity after lyophilisation was evaluated spectrophotometrically by gelatin hydrolysis, and residual moisture content was determined by the Karl Fischer method. It was found that the method of pre-freezing has a critical effect on the preservation of collagenase activity and the quality of lyophilisate. Controlled freezing (1°C/min) was found to be optimal, ensuring preservation of up to 85–95% of the initial enzyme activity and minimal residual moisture (1–3%). The results demonstrate the key role of the freezing step in lyophilisation of collagenase and are of practical importance for the development of stable enzyme drugs.
1. Введение
Коллагеназа — протеолитический фермент, расщепляющий нативные коллагеновые волокна
. Благодаря этому свойству она находит широкое применение в медицине (лечение ожогов, трофических язв, келоидных рубцов, экстракорпоральная обработка тканей) , и биотехнологии (выделение клеток, подготовка тканевых матриксов) , . Лиофилизация (сублимационная сушка) является одним из наиболее эффективных методов стабилизации термолабильных биопрепаратов, таких как ферменты, позволяя существенно продлить срок их хранения при сохранении биологической активности за счет удаления воды . Однако сам процесс лиофилизации сопряжен с рядом стрессовых факторов (замораживание, осмотический стресс, дегидратация), которые могут вызывать денатурацию белка, нарушение его третичной структуры и, как следствие, потерю каталитической функции . Особенно критичной стадией является предварительное замораживание, так как скорость и температура замораживания напрямую влияют на размер и форму образующихся кристаллов льда, что может приводить к механическому повреждению макромолекул и высушиваемой структуры . Поэтому оптимизация режимов лиофилизации, и в первую очередь этапа замораживания, является актуальной задачей для обеспечения качества и эффективности ферментных препаратов.Цель работы — комплексное изучение влияния различных методов предварительного замораживания на ход процесса лиофилизации и конечную ферментативную активность коллагеназы, а также определение оптимальных параметров процесса для максимального сохранения активности фермента.
2. Методы и принципы исследования
2.1. Материалы
Фермент: Коллагеназа типа I (производитель: Sigma-Aldrich, США).
Буферные системы: Компоненты специально разработанной оптимизированной стабилизирующей буферной системы (pH 7,4) для лиофилизации коллагеназы.
Субстрат для анализа активности: Высокоочищенный желатин.
Реактивы для анализа влажности: Реактивы для кулонометрического титрования по Карлу Фишеру (ОФС.1.2.3.0002.15 Определение воды. Государственная фармакопея Российской Федерации XIV, вып. 1)
Оборудование: Спектрофотометр, Лиофильная сушка.
Расходные материалы: Стеклянные флаконы типа 2R, резиновые пробки, алюминиевые колпачки.
2.2. Методы
2.2.1. Приготовление раствора
Состав буфера подобран для обеспечения максимальной стабильности фермента в процессе лиофилизации. Рабочий раствор коллагеназы типа I (Sigma-Aldrich, США) растворяли в оптимизированной буферной системе (pH 7,4) до концентрации 5 мг/мл. По 0,5 мл полученного раствора разливали в стеклянные флаконы типа 2R.
2.2.2. Лиофилизация коллагеназы
Таблица 1 - Параметры лиофилизации коллагеназы
Этап процесса | Параметры |
1. Подготовка образца | |
Фермент | Коллагеназа типа I (Sigma-Aldrich) |
Концентрация | 5 мг/мл в сформированном составе |
Объем на флакон | 0,5 мл |
Тип флакона | Флаконы 2R |
2. Предварительное замораживание | |
Метод 1 | −20°C (медленное замораживание) |
Метод 2 | −80°C (быстрое замораживание) |
Метод 3 | Жидкий азот (−196°C, ультрабыстрое замораживание) |
Метод 4 (рис 1) | Контролируемое замораживание в камере лиофилизатора со скоростью охлаждения 1°C/мин до -50°C |
3. Первичная сушка (сублимация) | |
Температура | −15°C |
Давление | 0,10 мбар |
Время | 24 часа |
4. Вторичная сушка (десорбция) | |
Температура | +25°C |
Давление | 0,05 мбар |
Время | 6 часов |
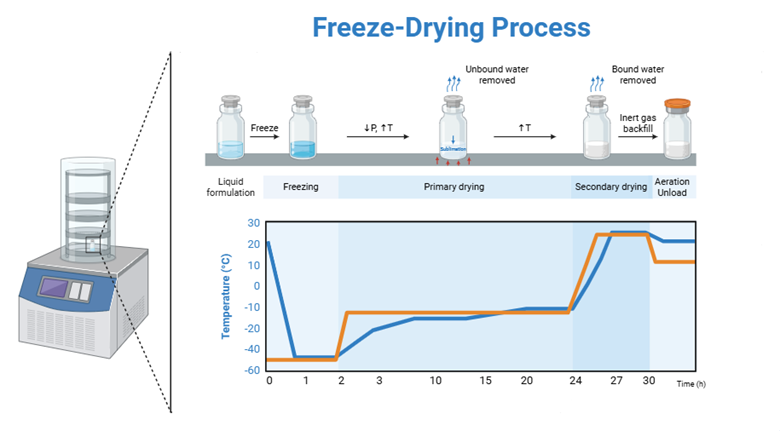
Рисунок 1 - Процесс лиофилизации с графиком с использованием предварительного замораживание по методу 4
Остаточную влажность лиофилизированных образцов определяли кулонометрическим титрованием по Карлу Фишеру в соответствии с методикой, описанной в Государственной Фармакопее Российской Федерации (ГФ РФ XIV издание, общая фармакопейная статья ОФС.1.2.3.0002.15 «Определение воды»). Измерения проводили в трех повторностях для каждого варианта лиофилизации.
2.2.4. Определение ферментативной активности
Ферментативную активность нативной и лиофилизированной коллагеназы оценивали спектрофотометрически по скорости гидролиза высокоочищенного желатина. Использовали модифицированный метод, основанный на измерении оптической плотности (ОП) продуктов реакции при длине волны 595 нм.
, .Активность рассчитывали по изменению ОП в единицу времени и выражали в процентах относительно активности нативного (не лиофилизированного) фермента, принятой за 100%. Измерения проводили в трех биологических повторностях.
3. Основные результаты
Результаты по четырем протоколам лиофилизации представлены в таблице 2 и наглядно на рисунке 2 и 3.
Таблица 2 - Полученные результаты
Метод замораживания | Активность, % | Остаточная влажность, % |
Метод 1 | Коллапс структуры | Высокая (более 10) |
Метод 2 | Средняя (70-85) | Средняя (3-6) |
Метод 3 | Средняя (50-75) | Высокая (5-10 и более) |
Метод 4 | Высокая (>85-95) | Низкая (1-3) |
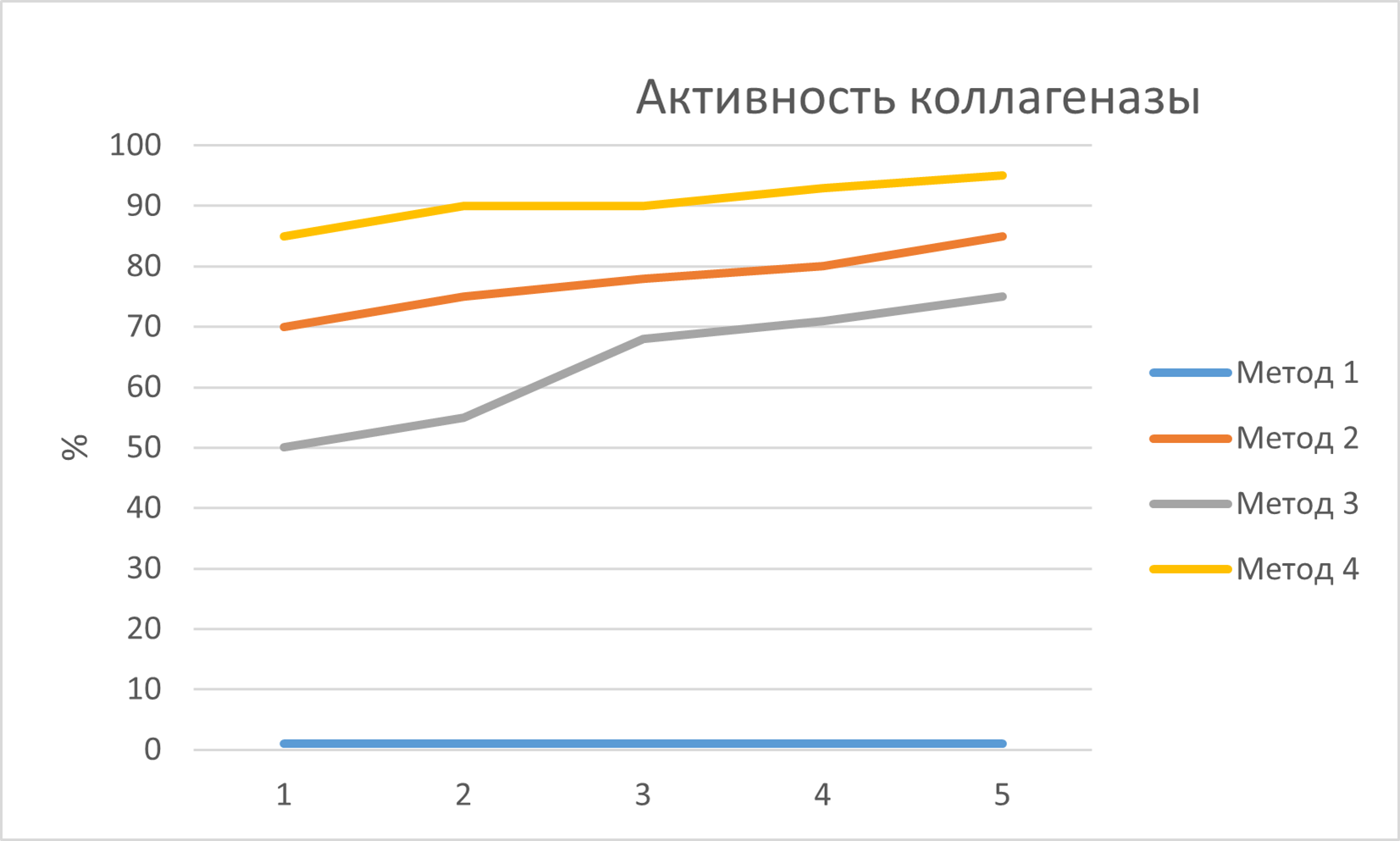
Рисунок 2 - График активности коллагеназы
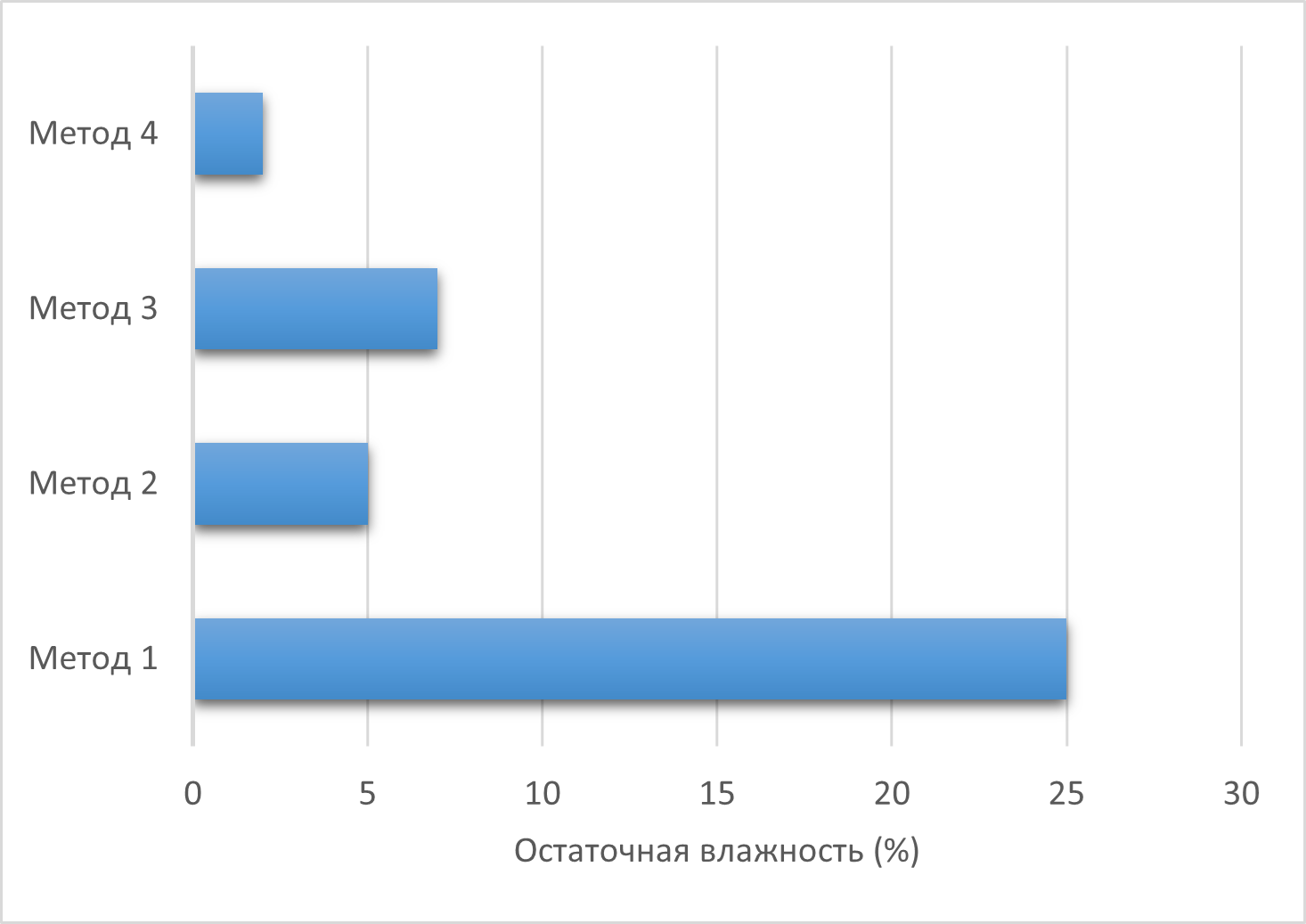
Рисунок 3 - График остаточной влажности
1. Метод 1 (Медленное замораживание при -20°C): привел к катастрофической потере активности (<10%) и образованию лиофилизата с высокой остаточной влажностью (>10%). Визуально наблюдался полный коллапс структуры , плавление и образование липкого осадка.
2. Метод 2 (Быстрое замораживание при -80°C): позволил сохранить значительную часть активности (70–85%) при остаточной влажности 3–6%. Наблюдалось незначительное сморщивание структуры. Быстрое замораживание приводит к образованию более мелких кристаллов, что снижает механическое повреждение , . Однако неравномерность охлаждения в морозильной камере, вероятно, не обеспечила идеальной структуры льда по всему объему образца.
3. Метод 3 (Ультрабыстрое замораживание в жидком азоте, -196°C): неожиданно показал наихудшие результаты после медленного замораживания по активности (50–75%) и влажности (5-10%). Визуально отмечалось сильное растрескивание и хрупкость торта, возможны следы плавления.
4. Метод 4 (Контролируемое замораживание в лиофилизаторе, 1°C/мин до -50°C): продемонстрировал наилучшие результаты. Сохранение активности составило 85–95% (в среднем около 90%), остаточная влажность была минимальной (1–3%). Лиофилизат имел ровную, пористую структуру без признаков коллапса или растрескивания. Контролируемое, медленное и равномерное понижение температуры обеспечило формирование крупной, но правильной кристаллической структуры льда. Такая структура создает оптимальные каналы для выхода водяного пара во время первичной сушки, способствуя эффективной сублимации и формированию стабильного, высокопористого каркаса. Это минимизирует стресс для белка и позволяет достичь глубокой сушки на этапе десорбции.
4. Обсуждение
Результаты однозначно указывают на критическую важность этапа предварительного замораживания для успешной лиофилизации коллагеназы. Полученные данные согласуются с общепринятыми представлениями в технологии лиофилизации: медленное замораживание приводит к коллапсу и потере активности, сверхбыстрое замораживание в массивных образцах часто неэффективно из-за неравномерности процесса. Оптимальным для данного препарата оказалось контролируемое замораживание со скоростью 1°C/мин до температуры -50°C, проводимое непосредственно в камере лиофилизатора. Этот режим обеспечил формирование оптимальной ледяной субстанции, что позволило провести эффективную сублимацию (первичную сушку) при -15°C и глубокую десорбционную сушку при +25°C без структурного разрушения «торта». Как следствие, была достигнута максимальная сохранность ферментативной активности (до 90-95%) и минимальная остаточная влажность (1–3%), что является ключевым для долгосрочной стабильности препарата.
5. Заключение
Проведенные исследования подтвердили гипотезу о существенном влиянии режима предварительного замораживания на эффективность лиофилизации и сохранение активности коллагеназы. Установлено, что:
Медленное (-20°C) и ультрабыстрое (жидкий азот) замораживание являются неоптимальными, приводя к значительной потере активности (менее 10% и 50–75% соответственно) и повышенной остаточной влажности (>10% и 5–10%).
Быстрое замораживание (-80°C) позволяет сохранить приемлемую активность (70–85%) при влажности 3–6%.
Контролируемое замораживание со скоростью 1°C/мин до -50°C в камере лиофилизатора является оптимальным методом для данного препарата коллагеназы, обеспечивая сохранение 85–95% исходной ферментативной активности и остаточную влажность на уровне 1–3%. Полученные результаты имеют важное практическое значение для разработки стабильных лекарственных форм и биотехнологических препаратов на основе коллагеназы. Рекомендованный режим замораживания может быть использован в технологических регламентах производства.
